| Головна |
| «« | ЗМІСТ | »» |
|---|
Білки, що надійшли в організм з їжею, в шлунково-кишковому тракті (ШКТ) розщеплюються до амінокислот при дії групи протеолітичних ферментів - пептідгідролаз за сучасною номенклатурою; широко відомо їх тривіальне назва - протеази, або протеїнази. Ці ферменти каталізують гідролітичні розщеплення пептидного зв'язку в білках, що представляє собою екзергонічсскій процес, при якому Д<7 має від'ємне значення і повністю зрушує рівновагу реакції в бік утворення продуктів реакції. Пептідгідролази відносяться за класифікацією ферментів до класу гідролаз, їх шифр КФ 3.4.1-3.4.4.
Властивості пептідгідролаз. Протеолітичні ферменти тварин і людини вивчені досить добре, в меншій мірі досліджені рослинні протеази.
Для протеолітичних ферментів характерний ряд загальних властивостей і особливостей.
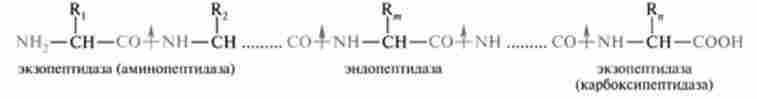
Ферменти, що розщеплюють білки, мають відносну субстратной специфічністю, яка визначається:
Внутрішні пептидні зв'язку розщеплюються ендопептидаз, кінцеві - екзопептідази:
Відомо, що швидкість гідролізу протеазами денатурованих білків вище, ніж нативних, оскільки при денатурації білків (наприклад, в шлунку під дією соляної кислоти при pH - 1,5-2,0) стають доступними для протеолізу внутрішні ділянки поліпептидного ланцюга, раніше щільно упаковані в компактну глобулу.
Все протеолітичні ферменти синтезуються у вигляді неактивних попередників, званих зімогенов або профермент, і таким чином клітини захищені від контакту з активною формою ферменту і автолиза. Перетворення зимогена в активний фермент відбувається шляхом незворотною кова-
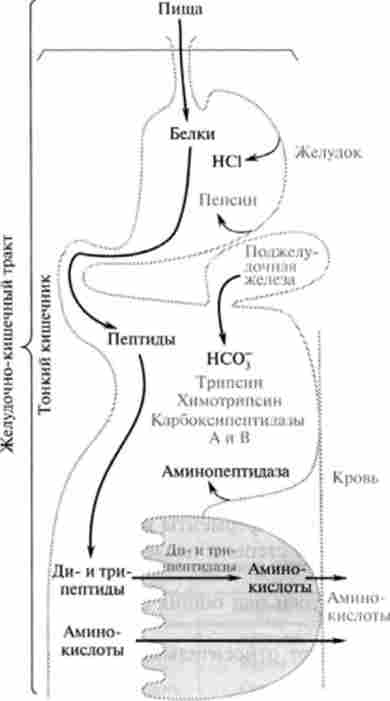
Мал. 24.2. Схема послідовної деградації харчова білків в шлунково-кишковому тракті
пентноі моошрікаціі зимогена за рахунок локального протеолізу, т. е. розриву однієї або декількох пептидних зв'язків і відщеплення обмеженого числа амінокислотних залишків. Це викликає конформаційні зміни в поліпептиді, достатні для формування просторової структури активного центру ферменту.
Загальна схема деградації білків їжі протеолітичнимиферментами в травному тракті представлена на рис. 24.2.
Розщеплення харчових білків починається з дії протеолітичного ферменту шлунка - пепсину. Спеціалізовані (періетальние) клітини епітелію шлунка секретіру- ють соляну кислоту, створюючи в шлунку кисле середовище (pH - 1,5-2.0). Цей фактор має важливе значення в перетравлюванні білків: денатурує білки їжі, має бактерицидну дію, вбиваючи потрапляють з їжею мікроорганізми, є який ініціює чинником активації пепсиногену і перетворення його в активну форму. Пспсіноген перетворюється на пепсин після відщеплення від нього 42 амінокислотних залишків, спочатку під дією соляної кислоти (повільно), а потім аутокаталітічно (дуже швидко). Молекулярна маса пепсиногена 40,4 kDa, пепсину - 32,7 kDa. Пепсин є ендонуклеази, і його дія призводить до накопичення суміші пептидів; найбільш активно він гідролізує пептидні зв'язки, NH-rpynna яких належить ароматичним амінокислотам - тирозину, фенілаланіну, триптофану. У слизовій шлунка людини виділено також протеолітичний фермент гастриксин, подібний за властивостями з пепсином.
Секреція соляної кислоти активується гистамином і гормонами гаст- рінамі. їх утворення пригнічується гормоном слизової дванадцятипалої кишки - секретин і гормоном гіпофіза - соматостатином.
Подальше перетравлювання високомолекулярних пептидів і білків, що не розщеплених пепсином, відбувається трьома ендопептидаз, виробленими підшлунковою залозою у вигляді попередників - трипсиногена, хи- мотріпсіногена і проеластази.
Процес перетворення трипсиногена в трипсин відбувається під дією ферменту, що виробляється в клітинах слизової оболонки кишечника - енте- ропептідази, а потім аутокаталітічно під впливом трипсину і зводиться до отщеплению з A-кінця поліпептиду шести амінокислотних залишків (рис. 24.3).
Трипсин має порівняно вузької субстратної специфічністю, розриваючи пептидні зв'язку, в утворенні яких беруть участь карбоксильні групи лізину і аргініну, т. Е. Основних амінокислот.
У підшлунковій залозі синтезується ряд хімотрипсин (а-, р-, я-хи мотріпсіни) з двох попередників - хімотріпсіногсна А і хімотріп- сіногена В. Активуються зімогени в кишечнику під дією активного трипсину і хімотрипсину.
Хімотрипсин володіє більш широкої субстратної специфічністю, ніж трипсин. Він каталізує гідроліз не тільки пептидів, але і ефірів, амідів і інших ацілпроізводних, хоча найбільшу активність він проявляє по відношенню до пептидним зв'язкам, в утворенні яких беруть участь карбоксильні групи ароматичних амінокислот - фенілаланіну, тирозину і триптофану.
У підшлунковій залозі синтезується ще одна ендопептідаза - еластаза. Назва фермент отримав від субстрату еластину, який він гідролізує. Еластин багатий гліцином і аланином, міститься в сполучній тканині. Еластаза володіє широким спектром дії, гидролизуя субстрати, які не розщеплюються трипсином і химотрипсином.
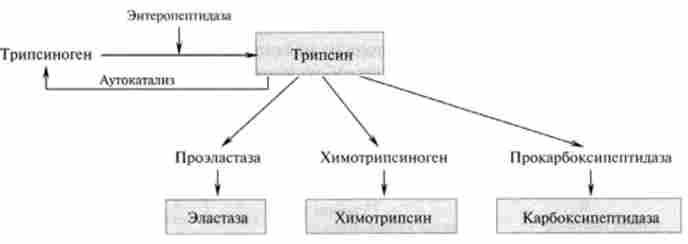
Мал. 24.3. Активація протеїназ в кишечнику
У перетравленні нативних білків і продуктів їх гідролізу в тонкому кишечнику активну участь беруть екзопептідази. Карбоксипептидази синтезуються в неактивному стані в підшлунковій залозі і активуються трипсином в кишечнику. Карбоксилу і пептідаза А гидролизует пептидні зв'язку С-кінцевих амінокислот, утворені переважно ароматичними амінокислотами (фенілаланін, тирозин, триптофан), а карбоксіпеп- тідаза В - зв'язку, в утворенні яких беруть участь С-кінцеві лізин і аргінін.
Амінопсптідази виробляються в клітинах слизової оболонки кишечника (ентсроцітах) відразу в активній формі. З кишкового соку виділені два типи аминопептидаз, що розрізняються за субстратної специфічності - Ала- нінамінопептідаза і лейцінамінопептідаза, перша з яких гидролизует пептидний зв'язок, утворену W-кінцевим аланином, а друга здатна гідролізувати практично будь-яку пептидний зв'язок, утворену УУ-кінці-виття амінокислотою.
Процес перетравлення пептидів, їх розщеплення до вільних амінокислот в тонкому кишечнику завершують три- і діпептідази.
При надмірному споживанні тваринних жирів і ряді патологій в нижніх відділах кишечника можливий розвиток гнильних і бродильних процесів. При дії мікрофлори кишечника відбуваються перетворення амінокислот, що отримали назву гниття білків в кишечнику. Так, в процесі глибокого розпаду сірковмісних амінокислот (цистину, цистеїну і метіоніну) в кишечнику утворюються сірководень H2S і меркаптан CH3SH. Діамінокіслоти, зокрема орнітин і лізин, піддаються процесу ДС карбоксилирования з утворенням диаминов, іноді званих трупними отрутами, оскільки вони утворюються також при гнильному розкладанні трупів. З орнитина утворюється путресцин, а з лізину - кадаверин:
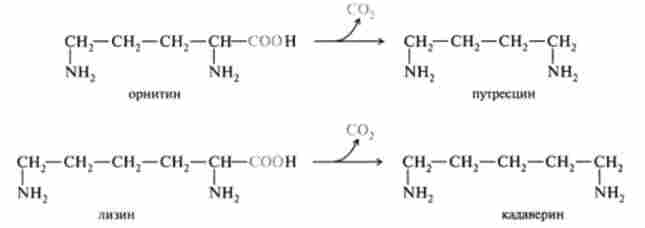
Слід зазначити, що порівняно недавно в тварин тканинах був відкритий фермент, що каталізує декарбоксилювання орнитина. Путресцин (продукт цієї реакції) поряд з 5-аденозил гомоцистеїну (продуктом декар- боксілірованія 5-аденізілметіоніна) бере участь в синтезі біологічно важливих поліамінів - сперміну і спермидина:
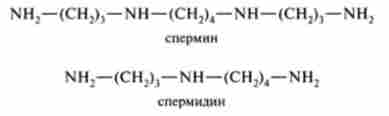
Поліаміни, в тому числі і диамин іутресцін, містяться практично у всіх тканинах і входять в основному до складу ядерного хроматину. Відомо їх участь в регуляції клітинного ділення, проте молекулярні механізми їх дії залишаються не до кінця з'ясованими.
З фенілаланіну, тирозину і триптофану при бактеріальному декарбок- сілірованіі утворюються відповідні біогенні аміни: фенілетіл- амін, / 7-гідроксіфенілетіламін (або тирамін) і індолілетіламін (тріпт- амін); при поступовому руйнуванні бічних ланцюгів циклічних амінокислот, зокрема тирозину і триптофану, утворюються отруйні продукти обміну: відповідно крезол і фенол, скатол і індол:
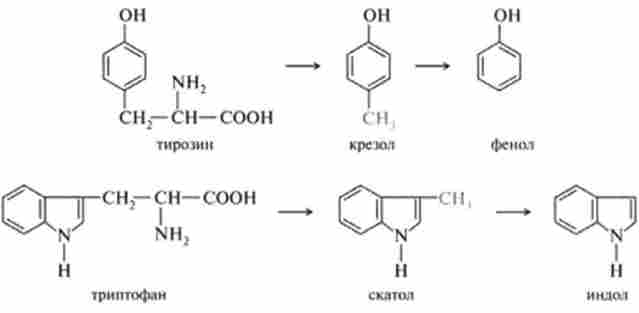
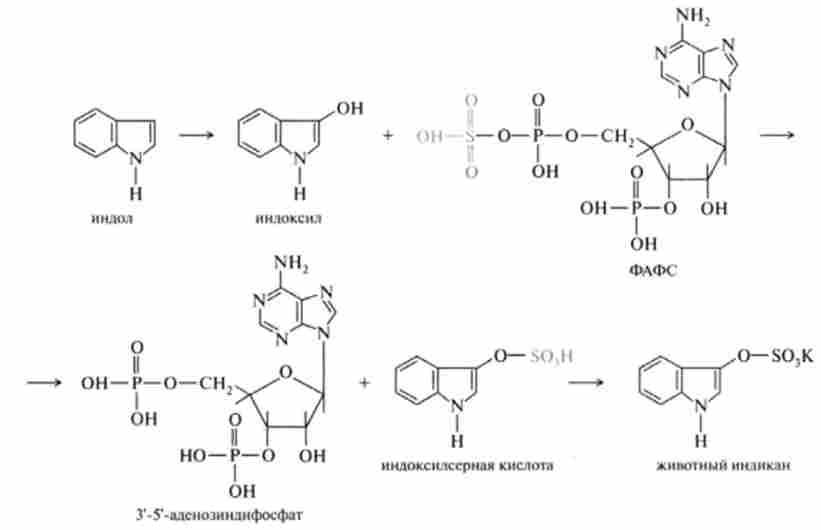
Індол і скатол знешкоджуються в печінці, попередньо окислюючись відповідно в індоксіл і скатоксіл, виводяться з організму у вигляді парних з'єднань, вступаючи в реакцію кон'югації з З-фосфоаденозін-5-фосфо сульфатом (ФАФС) або урідіндіфосфатглюкуроновой кислотою (УДФГК).
Як приклад наведена реакція детоксикації індолу, яка закінчується утворенням тваринного індікана, виведеного з сечею: