| Головна |
| «« | ЗМІСТ | »» |
|---|
Кількісно велектролітичні дисоціацію як рівноважний оборотний процес можна охарактеризувати константою дисоціації (іонізації), яка визначається законом діючих мас. Якщо розглядати велектролітичні дисоціацію як рівноважний оборотний процес, дисоціацію електроліту Kt "Anw (Kt + - катіон, Ап" - аніон) можна представити у вигляді
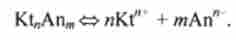
Відповідно до закону діючих мас константу рівноваги, звану константою дисоціації, записують наступним чином:

де [Kt "] і [Апл ] - молярні рівноважні концентрації іонів електроліту; [Kt "Anm] - молярна рівноважна концентрація недіссоціірованних молекул електроліту; Доа - константа дисоціації (моль / л).
Наприклад, для дисоціації оцтової кислоти СН3СООН
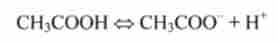
константа дисоціації дорівнює
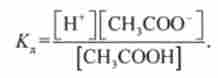
Рівняння (8.3) справедливо лише для розбавлених розчинів слабких електролітів. При використанні його для концентрованих розчинів і розчинів сильних електролітів рівняння (8.3) потрібно видозмінити.
Чим більше константа дисоціації / Гд, тим сильніше дисоціює електроліт. На відміну від ступеня дисоціації Доя залежить тільки від природи розчинника, електроліту і температури, але практично не залежить від концентрації розчину (табл. 8.4). Таким чином, і константа Доау і ступінь електролітичноїдисоціації аі - кількісні характеристики дисоціації. Природно, що між ними існує зв'язок.
Нехай є дисоціюють на два іона слабкий бінарний електроліт KtAn, молярна концентрація якого з (Х), а ступінь дисоціації а ". У розчині цього електроліту встановиться рівновага.
Застосувавши закон діючих мас до іонного рівноваги
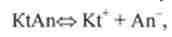
отримують вираз для Дол:
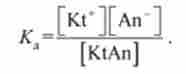
Підставивши вирази для концентрацій через ступінь дисоціації а ", отримують:

Це співвідношення називають законом розведення Оствальда (1888).
Рівняння (8.4) виражає залежність ступеня дисоціації від концентрації розчину. Якщо електроліт дуже слабкий, а "« 1. Отже, величиною а "в знаменнику можна знехтувати і рівняння (8.4) набуде вигляду
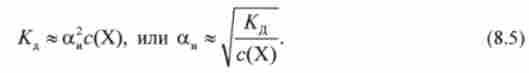
Відповідно закон Оствальда може бути сформульовано таким чином.
Ступінь дисоціації слабкого електроліту зростає з розведенням розчину.
Сильні електроліти не підкоряються цим законом. Для них ДоД не є постійною величиною і залежить від концентрації розчину (сильні електроліти не підкоряються закону діючих мас). Тому застосовність закону розведення Оствальда є одним з ознак слабких електролітів. У табл. 8.5 наведені значення констант дисоціації деяких слабких електролітів.
Таблиця 8.5
Константи дисоціації деяких слабких електролітів при 298 К
|
з'єднання |
K " моль / л |
з'єднання |
До " моль / л |
||
|
А '. |
^ 2 |
А ', |
А * |
||
|
HCN |
4,9-Ю'10 |
НСООН (мурашина кислота) |
1,76-104 |
||
|
H2S |
8.9 10 * |
1,3 10 13 |
СН3СООН (оцтова кислота) |
1,76-10 5 |
|
|
H2SO, |
1,3-10 2 |
6.3-10 * |
CHjCH2COOH (пропіонова кислота) |
1,35-10'5 |
|
|
H2c0j |
4.5-10'7 |
4,7-10 ' " |
СН, СН (ОН) СООН (молочна кислота) |
1,4-10"4 |
|
|
H3P04 |
7.6-10'3 |
6.2-10* |
СН3СО-СООН (піровіногралная кислота) |
3,2-10"3 |
|
|
NH40H |
1.8 10 s |
(Ноос-СН2)2З (ОНКСООН) (лимонна кислота) |
1.2-10 "3 |
7.3-10"5 |
|
|
Pb (OH2) |
9.6-10 4 |
3-10 * |
Н2З204 (щавелева кислота) |
5.6-10"2 |
5, МО-5 |
|
CO (NH2)2 (Сечовина) |
1,510 м |
||||
Примітка. Доj для Н3РО4 дорівнює 3,3-10 13 моль / л, для лимонної кислоти - 1,6 * 10-6 моль / л.
Багатоосновні кислоти дисоціюють ступінчасто. Наприклад, дисоціація фосфорної кислоти відбувається в три ступені:
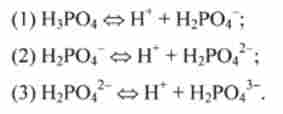
Дисоціація сходами характеризується константами
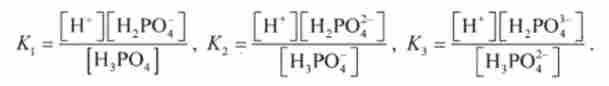 сумарне рівновагу
сумарне рівновагу
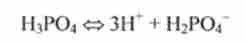
визначає сумарна константа дисоціації:
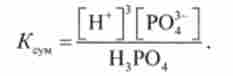
Легко переконатися, що сумарна константа і константи дисоціації окремих ступенів пов'язані один з одним співвідношенням
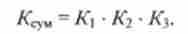
Ступінчаста дисоціація характеризується тим. що розпад електроліту по кожному наступному рівні відбувається в меншій мірі, ніж за попередньою, т. е. До До2 К).
Силу електроліту можна виразити іншим, більш зручним способом. Замість константи дисоціації Дол часто використовують її десятковий логарифм, узятий з оберненим знаком: рКл = -lg Доя.
Наприклад, для оцтової кислоти СНзСООН константа дисоціації Доа = 1,76-10 5 моль / л. Відповідно /> / (д (СНзСООН) = 4,76.