| Головна |
| «« | ЗМІСТ | »» |
|---|
Білки (протеїни) (від грец. То лреото - головний, перший) представляють собою високомолекулярні органічні полімерні речовини, побудовані з хімічно подібних мономерів, званих амінокислотами. Клітини містять від 10 до 20% білків, хоча в деяких клітинах їх набагато більше - 50-80%. Молекула будь-амінокислоти може бути представлена наступним чином:
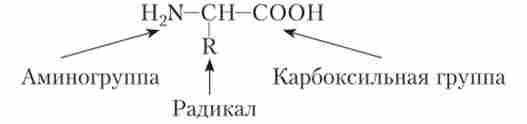
До складу білків зазвичай входить близько 20 амінокислот, хоча зустрічаються і дуже рідкісні амінокислоти (6-7 видів). Серед амінокислот виділяють замінні, які синтезуються в самому організмі, і незамінні, одержувані з їжею.
Білки діляться на протеїни, які складаються виключно з амінокислот, і протеїди, містять небілкової частина (наприклад, гемоглобін, який складається з білка глобіну і небілкової частини - гема).
У будь-яких білках полімерна ланцюжок з амінокислот утворюється за рахунок формування зв'язків між аміногрупою однієї амінокислоти і карбоксильної групою іншої амінокислоти. Такий зв'язок називається пептидного.
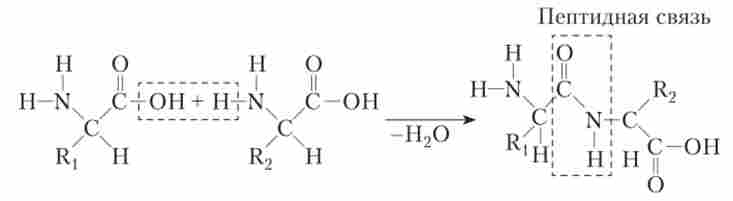
Освіта пептидного зв'язку. Rj і R2 - частини молекул, що розрізняються у різних амінокислот.
Білки характеризуються багатоструктурний організацією, при якій кожна наступна структура ускладнює попередню. первинна структура являє собою ланцюжок з амінокислотних залишків, сполучених пептидними зв'язками. вторинна структура - це спіраль (альфа- спіраль), утворена амінокислотної ланцюжком. Спіраль утримується за допомогою водневих зв'язків, які виникають між NH- і С = 0 - групами зближених один до одного амінокислотних залишків. третинна структура білка є зазвичай згорнуту в кулю (глобулу) альфа-спіраль. Глобула підтримує форму за рахунок іонних, водневих і ковалентних дисульфідних зв'язків, а також гідрофобних взаємодій амінокислотних залишків.
четвертичная структура білка утворюється за рахунок взаємодії декількох глобул (так, гемоглобін складається з чотирьох таких субодиниць) (рис. 1.2).
Втрата молекулою білка своєї структури при значному підвищенні температури, зневодненні, опроміненні називається денатурацією (рис. 1.3).
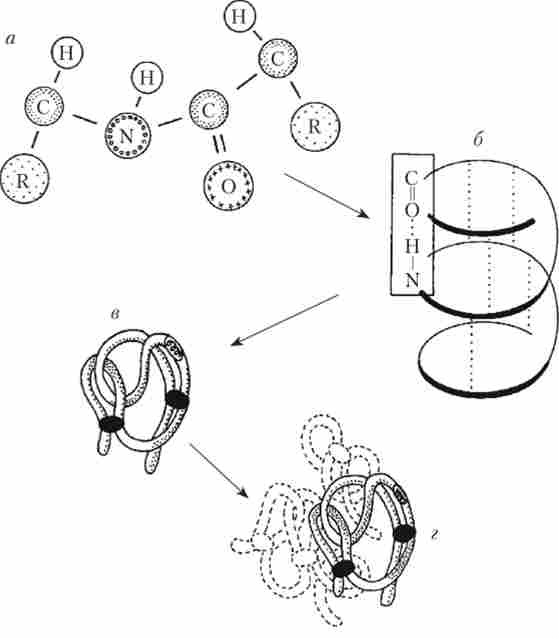
Мал. 1.2. Структура молекули білка:
а - первинна; б - вторинна; в - третинна; г - четвертичная
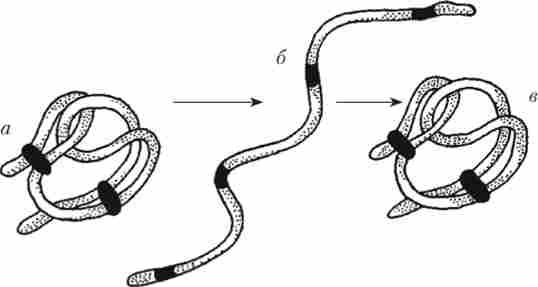
Мал. 1.3. Оборотна денатурація білка:
а - молекула білка до денатурації; б - денатурований білок; в - відновлена вихідна структура білка
Функції білків. У клітинах і в цілому організмі білки виконують велику кількість найважливіших функцій.
структурна (будівельна) функція білків полягає в тому, що вони є важливими елементами клітинних мембран, НЕМЕМБРАННИХ органоїдів клітини і міжклітинної речовини. Так, колаген є важливим складовим компонентом сполучної тканини, кератин - компонент волосся і нігтів, еластин - еластичний компонент зв'язок і стінок кровоносних судин. На сьогоднішній день виявлено цілий ряд так званих нейроснеціфічних білків, що зустрічаються головним чином в клітинах НС і виконують в ній різні функції. Пошкодження цих білків тягне за собою важкі розлади роботи мозку і периферичної НС.
ферментативна (каталітична) функція білків полягає в тому, що особливі білкові молекули, звані ферментами, здатні прискорювати перебіг біохімічних реакцій в клітці в сотні мільйонів разів.
Молекули одних ферментів складаються тільки з білків, інші включають, крім білка, небілкових з'єднання, або кофермент. Як коферментів виступають різні з'єднання, як правило, вітаміни і неорганічні речовини - іони різних металів (рис. 1.4).
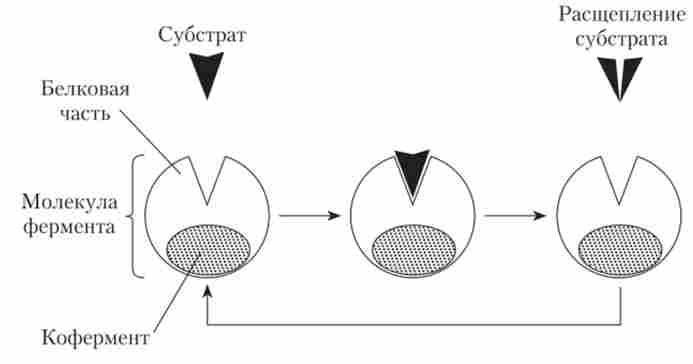
Мал. 1.4. Схема реакції за участю ферменту
Транспортна функція білків полягає в тому, що особливі білки здатні специфічно зв'язувати ті чи інші речовини і переносити їх по кровоносних судинах. Так, гемоглобін переносить кисень з легень до клітин інших тканин. Транспортні білки існують для багатьох гормонів.
Захисна функція білків полягає в запобіганні організму від вторгнення бактерій, вірусів, найпростіших, а також впливу отруйних речовин. Так, антитіла, що виробляються лімфоцитами, блокують чужорідні білки; інтерферони забезпечують противірусний захист. Крім того, особлива білкова система крові оберігає організм від кро- вопотері, утворюючи тромб в ушкодженому посудині.
Регуляторна функція властива білкам-гормонів, які контролюють хід більшості фізіологічних процесів в організмі. Наприклад, інсулін регулює вміст глюкози в крові.
Рухова функція білків пов'язана з їх участю в механізмах руху окремих клітинних органел, окремих клітин, частин організму або організму в цілому. Найбільш важливими для забезпечення руху є білки актин і міозин, які забезпечують скорочення м'язових клітин, необхідні для транспорту різних речовин по відростках нейронів, входять до складу цитоскелету, беруть участь в організації амебоидних рухів і ін.
Сигнальна функція білків полягає в тому, що сприйняття сигналів із зовнішнього середовища і змін у внутрішньому середовищі організму здійснюється через спеціалізовані освіти - рецептори. Існують зорові, механічні, смакові, нюхові та інші рецептори, в основі роботи яких лежать рецепторні білки, здатні у відповідь на специфічні впливу певної сили формувати сигнали, що досягають мозку. Таким чином, механічний рецептор у відповідь на дотик забезпечує виникнення тактильних відчуттів, зоровий рецептор у відповідь на кванти світла - зорові відчуття і т. Д.
енергетична функція не відноситься до основних функцій білків, хоча розпад 1 г білка призводить до виділенню 17,6 кДж енергії. Білки відіграють таку важливу роль в організмі, що витрачати їх таким чином не вигідно. Тим більше що в процесі окислення аміногрупи амінокислот утворюються дуже отруйні азотовмісні сполуки, які необхідно безперервно знешкоджувати. Тому «непотрібні» білки розпадаються до окремих амінокислот, а ці амінокислоти повторно використовуються для синтезу нових білків, необхідних організму.
Роль білка в житті клітини величезна. Різниця і схожість організмів визначаються в кінцевому рахунку присутніми в них білками. Чим ближче організми один до одного в систематичному положенні, тим більше подібні за амінокислотним складом їх білки.