| Головна |
| «« | ЗМІСТ | »» |
|---|
В даний час відомо про існування різних систем регуляції активності (експресії) генів, які функціонують на тому чи іншому етапі реалізації генетичної інформації. Перша модель генетичного контролю біосинтезу білків, що поклала початок сучасної теорії генетичної регуляції, була запропонована французькими вченими Ф. Жакобом і Ж. Моно на основі експериментів, проведених з клітинами бактерій. Ці автори ввели поняття про оперон як одиниці координованої експресії генів (одиниці генетичної регуляції).
концепція оперона була розроблена Ф. Жакобом і Ж. Моно на прикладі регуляції синтезу ферментів, необхідних для використання вуглеводу лактози клітинами кишкової палички (Escherichia coli). Лактоза є дисахарид, молекула якого є з'єднанням, що складається з глюкози і галактози. Згідно запропонованої моделі, в рамках оперона відбувається регуляція активності структурних генів на етапі транскрипції генетичної інформації.
У складі лактозного оперона Е. coli знаходяться структурні гени, позначені символами z, у, а, які кодують синтез трьох різних білків-ферментів, що беруть участь в утилізації лактози (рис. 5.29). Так, фермент р-галактозидаза розщеплює молекулу лактози з утворенням молекул двох моносахаридів (глюкози і галактози), галактозідпермеаза забезпечує активний транспорт лактози в бактеріальну клітину з навколишнього середовища, тоді як роль третього ферменту (трансацетілази або А-білка) точно не встановлена.
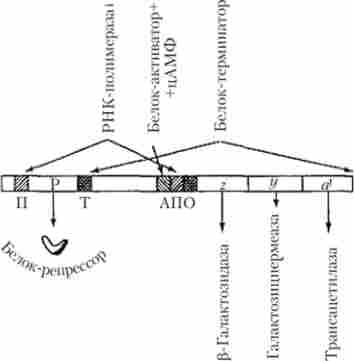
Мал. 5.29. лактозна оперон Е. coli: П - промотор; Р - гсн-рсгулятор; Т - термінатор;
А - ділянка прикріплення білка-активатора; Про - оператор; г, у, а - структурні гени
Крім зазначених генів в спгруюуре оперона виділяються акцепторні ділянки (специфічні нуклеотидні послідовності ДНК), які необхідні для прикріплення білка-активатора (ділянка активатора), РНК-полімерази (промотор) і білка-регулятора, названого репрессором (оператор), а також термінатор, що забезпечує припинення синтезу полігенною мРНК (рис. 5.29). Однак слід зауважити, що в рамках сучасної теорії генетичної регуляції ділянку активатора і оператор прийнято розглядати як складову частину промоторной області.
Функціонування лактозного оперона Е. coli засноване на принципі, який Ф. Жакоб і Ж. Моно назвали негативної індукції, оскільки в цьому випадку регулює білок (репрессор) проявляє негативний ефект, блокуючи транскрипцію структурних генів z, у а, тоді як сама лактоза виступає в якості індуктора цього процесу, що супроводжується синтезом відповідних ферментів (рис. 5.30).
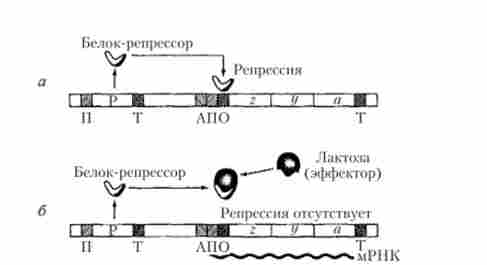
Мал. 5.30. Процеси в лакгозном оперон Е. coli: а - репресія; б - індукція
При відсутності лактози в бактеріальної клітці синтезується активний білок-репрессор під контролем гена-регулятора, принципово не відрізняється від звичайного структурного гена, володіючи власним промотором і термінатором. Активний репрессор, що представляє собою складний аллостерічеський тетрамерний білок, з'єднується з нуклеотидної послідовністю оператора, блокуючи в стартовій точці гена ініціацію транскрипції, яку повинна здійснювати РНК-полімераза, попередньо зв'язавшись з впізнаваною нею нуклеотидной послідовністю промоторной області. Принциповий сенс механізму репресії цього оперона схематично зображено на рис. 5.30, а.
Поява лактози в середовищі існування бактерій може супроводжуватися проникненням невеликих її кількостей в бактеріальну клітину. При цьому лактоза починає виступати в ролі ефектора, приєднуючись до певної ділянки молекули білка-репрессора, що призводить до зміни конфігурації цієї молекули і її інактивації (аллостерічеський ефект). Оскільки неактивний репрессор втрачає здатність з'єднуватися з оператором, то стають можливими ініціація транскрипції і подальший безперервний синтез полігенною молекули мРНК, припиняється в області термінатора, а також синтез трьох зазначених ферментів на етапі трансляції генетичної інформації (рис. 5.30, б). Ці ферменти, в свою чергу, забезпечують швидке проникнення лактози в клітину з навколишнього середовища і її подальше розщеплення на глюкозу і галактозу. Процес транскрипції знову буде заблокований безперервно синтезується репрессором після розщеплення всієї лактози, наявної в клітці, при її відсутності в навколишньому середовищі.
Таким чином, робота лактозного оперона (як і інших вивчених бактеріальних оперонов) здійснюється за принципом саморегуляції на основі зворотного зв'язку, згідно з яким час синтезу і кількість синтезованого білка-ферменту визначаються його необхідністю для забезпечення того чи іншого метаболічного процесу, пов'язаного з життєдіяльністю клітини.
У процесі подальшого вивчення лактозного оперона та інших оперонов бактерій були отримані відомості про те, що крім негативного (репрессорного) механізму регуляції транскрипції в них діє також позитивний механізм, пов'язаний з функціями різних білків, які є активаторами транскрипції. Так, в разі лактозного оперона встановлено існування такого білка, який, в свою чергу, активується шляхом попереднього зв'язування з циклічним аденозінмоно фосфатом (цАМФ). Зазначений білок-активатор з'єднується зі специфічним ділянкою на початку промоторной області (див. Рис. 5.29), який містить послідовність, впізнавану РНК-полімерази, і забезпечує нормальне прикріплення і подальше функціонування останньої.
Було встановлено також, що такий білок, активоване цАМФ, є фактором позитивної регуляції транскрипції не тільки лактозного оперона, але і декількох інших Катаболізує оперонов Е coli. Якщо в клітці є достатня кількість глюкози або іншого легко засвоюється моносахарида, то активується робота відповідного оперона, що забезпечує утилізацію такого вуглеводу. При цьому значно знижується концентрація цАМФ, що призводить до репресії групи оперонов, включаючи лактозна, пов'язаних з утилізацією дисахаридов. Якщо в клітці немає достатньої кількості глюкози і інших моносахаридів, то концентрація синтезованого цАМФ зростає. У зв'язку з цим при наявності лактози стає можливою активація роботи лактозного оперона за допомогою білка-активатора, що забезпечує нормальне функціонування РНК-полімерази в цьому оперон, т. Е. Бактерії починають використовувати менш вигідний, ніж глюкоза, джерело вуглецю. Є також експериментальні дані, що показують, що додавання цАМФ в живильне середовище, в якій розмножуються бактерії, знімає катаболітной репресію лактозного і інших подібних оперонов. Отже, у прокаріотів може мати місце узгоджена регуляція функціонування різних оперонов на стадії ініціації транскрипції.
Потрібно, однак, мати на увазі, що регуляція активності генів прокаріот на етапі транскрипції нс обмежується лише стадією ініціації цього процесу, але здійснюється також під час його елонгації і термінації.
Що стосується еукаріот, включаючи людину, то внутрішньоклітинна регуляція біосинтезу білків у цих організмів набагато складніша і менш вивчена, ніж у бактерій і вірусів, що пов'язано насамперед з особливостями організації їх геномів.
Як було зазначено вище, ініціація транскрипції в еукаріот тісно пов'язана з наявністю тих чи інших специфічних послідовностей в складі промоторной області окремих генів, які повинні дізнаватися відповідної РНК-полімерази. При цьому для РНК-полімерази різних типів (I, П, 1П і ін.) Повинні існувати відрізняються один від одного послідовності. Як і в разі прокаріотів, такі послідовності повинні розпізнаватися відповідними специфічними белкамі- активаторами (факторами транскрипції), за допомогою яких здійснюється правильне прикріплення і активація певної РНК-полімерази, що є обов'язковою умовою для ініціації транскрипції. Стадії елонгації і термінації транскрипції в еукаріот також забезпечуються участю білкових факторів, що регулюють ці процеси.
Як відомо, до числа особливостей еукаріот відноситься переривчаста (мозаїчна) структура їх генів і пов'язаний з цим процесинг РНК. Вище розглянута можлива роль интронов в регуляції процесингу мРНК і сплайсингу екзонних ділянок структури еукаріотичного гена. В даний час є дані про те, що крім звичайного (типового) сплайсингу в деяких випадках можливо також поява його альтернативного варіанту, пов'язаного зі зміною порядку з'єднуються екзонних фрагменггов. Так, наприклад, якщо при типовому варіанті сплайсингу мРНК, що складається з 5 екзонних ділянок, відбувається їх з'єднання в послідовності 1-2-3-4-5, то при альтернативному сплайсинг можливі інші варіанти (2-3-1 -4-5; 3-4-2-1-5 і ін.). В результаті на основі однієї і тієї ж нуклеотидноїпослідовності конкретного гена можуть формуватися різні варіанти білкових молекул, які будуть являти собою структури, що складаються з різних сполучень одних і тих же амінокислотних блоків. Отже, в цьому випадку проявляється принцип досить економного використання наявної генетичної інформації еукаріотичного організму в різні періоди його життєдіяльності.
У еукаріот спостерігається також групова регуляція активності генів на етапі транскрипції, пов'язана з особливостями організації гетерохроматинових і еухроматінових ділянок їх хромосом.
В даний час відомі механізми регуляції активності генів, які діють і на етапі трансляції генетичної інформації в клітині. У бактерій є не менше трьох білкових чинників, що беруть участь в регуляції ініціації трансляції, які позначаються символами IF-1, IF- 2, IF- 3 (від англ, initiation factor - фактор ініціації). При утворенні ініціюючого комплексу (див. Рис. 5.20) фактор IF-видання зв'язується з 305-субодиницею рибосоми, перешкоджаючи передчасному об'єднанню малої і великої субодиниць. фактор ініціації IF-2 з'єднується з ініціації аміноацил-тРНК, що несе формілметіонін, і за участю IF-1 забезпечує її правильне прикріплення до / '- ділянки малої субодиниці рибосоми, завершуючи формування ініціюючого комплексу. Ініціація закінчується об'єднанням рибосомних субодиниць 305 і 505 (див. Рис. 5.20), яке супроводжується звільненням усіх трьох факторів ініціації, які покидають рибосому. У еукаріот є інший набір факторів ініціації трансляції, механізм дії яких менше вивчений.
Стадії елонгації і термінації трансляції також регулюються відповідними білковими факторами як у прокаріотів, так і у еукаріот. Як зазначалося вище, завершення трансляції пов'язане з вступом б ^ -ділянку рибосоми одного з терминирующего кодонів мРНК (УАА, УАГ, УГА). Ці кодони впізнаються відповідними білковими факторами термінації, які забезпечують руйнування зв'язку між останньою тРНК і мРНК в / P-ділянці рибосоми і звільнення синтезованого поліпептиду, а також дисоціацію рибосомних субодиниць.
Можна вважати, що регуляція експресії генів здійснюється і на етапі посттрансляційної модифікації поліпептидів, проте механізми такого регулювання досліджені недостатньо.
Оцінюючи особливості генетичної регуляції біосинтезу білків у еукаріот, необхідно відзначити, що в разі багатоклітинних організмів, включаючи людину, її механізми є виключно складними і мають багаторівневий характер, не обмежуючись лише процесами, що відбуваються в рамках однієї клітини.
Для ссавців і людини встановлено існування великого числа факторів регуляції різних надклеточних рівнів: тканеспецифичних і органоспецифічних білків-активаторів, факторів нервової та ендокринної систем і ін.