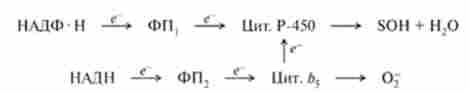
| Головна |
| «« | ЗМІСТ | »» |
|---|
Реакції мікросомального окислення катализируются НАДФН- і НАДН-залежними ферментними системами в присутності кисню. НАДФН-залежний флавопротсін переносить електрон від відновленого НАДФН на термінальний фермент - цитохром Р-450. відновлюючи залізо гема останнього. Крім того, в моно- оксігеназной реакціях бере участь НАДН-залежний ферментний комплекс, що складається з НАДН-залежної флавопротеїнів і цитохрому Л5. В цьому випадку електрон переноситься на кисень і активує його:
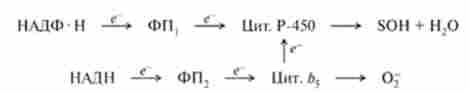
У ряді випадків електрон з цитохрому Ь5 надходить на цитохром Р-450 і бере участь у відновленні заліза гема. НАДФН-залежний флавопротеїнів є димер з молекулярної масою 40,5 kDa, причому кожна субодиниця містить 1 молекулу ФАД. Цігохром Ь5 є мономером з молекулярної масою 13 kDa.
Ключовим ферментом системи мікросомального окислення є цитохром Р-450. Цей гемопротеинов також є мономером, що містить одну Геміні угруповання і мають молекулярну масу 45 kDa.
Саме цитохром Р-450, приєднуючись до відповідного субстрату, запускає реакції його біотрансформації.
Виникає питання: наскільки універсальна дана окислювальна система в зв'язку з великою кількістю каталізуються нею реакцій? Було доведено існування набору ізоензимів цитохрому F-450, причому кожен з них має свої власні типи субстратів, по відношенню до яких він має підвищену специфічність. Молекулярні форми цитохрому Р-450 є істинними ізоензимами, т. Е. Вони кодуються різними генами або різними алелями одного гена, відрізняються деякими фізико-хімічними властивостями, але мають одну і ту ж Геміні угруповання. Встановлено, що всі досліджені організми від бактерій до людини мають набір ізоензимів цитохрому Р-450. Субстрати можуть зв'язуватися з цитохромом Р-450 по крайней мере двома різними способами. Одна група субстратів зв'язується з білкової частиною цитохрому Р-450, в той час як інша група субстратів взаємодієте залізом Геміні угруповання ензиму.
Тип зв'язування ферменту з субстратом може бути встановлений за допомогою спектральних методів, оскільки зв'язування субстратів з цитохромом Р-450 змінює його спектральні характеристики. Вимірювання спектра ферменту в присутності субстрату з використанням розчину ферменту без субстрату в якості контролю дає так званий спектр відмінності. Субстрати, які зв'язуються з білковою частиною цитохрому Р-450, мають спектр відмінності при 390 нм. Такі субстрати називаються субстратами першого типу.
Інша група субстратів зв'язується з Геміні угрупованням ферменту. Ці субстрати мають спектри відмінності з максимумом близько 420 нм, вони називаються субстратами другого типу.
Спектральні зміни пов'язані зі спінові станом атома заліза в складі Геміні угруповання цитохрому Р-450.
Атом заліза має координаційне число 6. Чотири зв'язку локалізовані в протопорфірінового кільці, п'ята взаємодіє з цістеінового залишком поліпептидного ланцюга, а шоста пов'язана з гідроксильною групою молекули води (рис. 32.2).
Зв'язування субстрату з цитохромом Р-450 викликає зміни в електронній конфігурації атома заліза. У вільному Ензим більшість атомів заліза знаходиться в нізкоспіновом стані. зв'язування субстратів
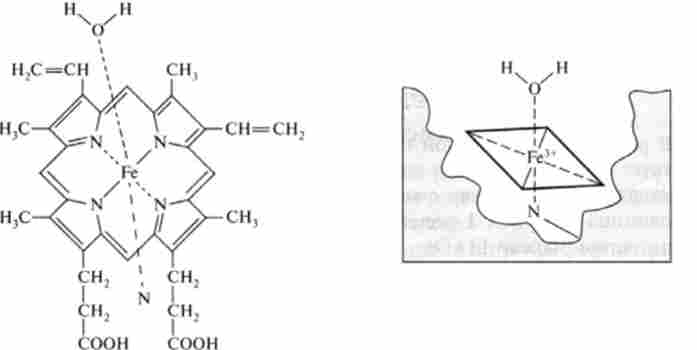
Мал. 32.2. Будова гема і його зв'язок з білком в цитохроме Р-450
першого типу з білкової частиною цитохрому Р-450 викликає перехід заліза з нізкоспінового в високоспіновое стан, і це супроводжується спектральними змінами в області 390 нм.
Зв'язування субстратів другого типу відбувається з шостий координаційної зв'язком заліза гема, що індукує перехід з високоспінового в нізкоспіновое стан.
Крім субстратів першого і другого типів, існують ще так звані зворотні субстрати, які при низьких концентраціях подібні субстратів першого типу, а при високих - другого типу. Ряд речовин утворює незворотні комплекси з залізом Геміні угруповання цитохрому Р-450, що призводить до інактивації останнього.