
| Головна |
| «« | ЗМІСТ | »» |
|---|
Як правило, ці білки класифікують за небілкова компоненту.
Ліпопротеїни складають велику групу складних білків. Ці макромолекули в значних кількостях знаходяться в мітохондріях, з них в основному складається ендоплазматичнийретикулум, їх виявляють і в плазмі крові, і в молоці. Як правило, ліпопротеїни - це великі молекули. Їх молекулярна маса досягає мільйона дальтон. Гідрофільність білкової і гидрофобность простетичної груп ліпопротеїнів визначають ту роль, яку вони відіграють у процесах виборчої проникності. Ліпіди, що входять до складу ліпопротеїнів, відрізняються за будовою і біологічними властивостями. Зокрема, в складі ліпопротеїнів відкриті нейтральні ліпіди, фосфоліпіди, холестерин та ін. Ліпідний компонент з'єднується з білком за допомогою нековалентних зв'язків різної природи. Так, нейтральні ліпіди з'єднуються з білком за допомогою гідрофобних зв'язків. Якщо ж в освіті ліпопротеїну бере участь фосфолипид, то він взаємодіє з білком за допомогою іонних зв'язків.
Глікопротеїни - містять в своєму складі гликозидні компоненти різної природи, ковалентно пов'язані з білком. Невеликі олігосахарід- ні групи можуть приєднуватися до білків через О-глікозидний зв'язок до гідроксилу залишків серину або треоніну, а також через N-глікозидний зв'язок до зовнішньої поверхні тварин клітин, є глікопротеїнами. У плазмі крові також міститься велика кількість глікопротеїнів. Слід зазначити групу гликозамингликанов, в яких в якості небілкового компонента знаходяться кислі мукополісахариди. Зміст вуглеводного компонента в глікопротеїну варіює в широких межах (від 1 до 30% маси всієї молекули). Більш того, на одну поліпептидний ланцюг може припадати кілька лінійних або розгалужених вуглеводних ланцюгів.
У вуглеводному компоненті гликопротеинов виявлені такі моносахариди, як D-галактоза, D-маноза, D-глюкоза, УУ-ацетілгалактозамін, Л ^ -аце- тілглюкозамін і ін.
Фосфопротеіни як простетичної групи містять ортофосфор- ву кислоту, пов'язану з гідроксилом серина або треоніну. До фосфопро- Теїн відносяться багато поживних білки, наприклад основний білок молока - казеїн, який крім фосфорної групи має також в своєму складі вуглеводний компонент. Білок яєчного жовтка - вителлин, ікри риб - іхту- лин.
Хромопротеїни - складні білки, до складу яких входять пофарбовані небілкові компоненти. Найбільш поширеними представниками хромопротеїни є флавопротеїни, у яких в якості небілкових компонентів включені флавинмононуклеотид і флавінаденіндінуклеотід, а також гемопротеїни, червоне забарвлення яких обумовлено наявністю гема з включеним в нього залізом. Цей пігмент являє собою плоску структуру, що складається з чотирьох піррольних кілець, в центрі координації яких знаходиться атом заліза. Координаційне число заліза в складі гема дорівнює 6, причому чотири зв'язку зайняті азотами піррольних кілець, п'ята пов'язує гем з білком, а шоста - зайнята тим чи іншим лігандом. Піррольних кільця з'єднані метановими містками, утворюючи тетрапіррольних кільце, до якого приєднані вінільні, метильние і пропіонатние угруповання (рис. 3.16).
Гем є простетичної групою всього сімейства гемопротеинов, найбільш відомий представник яких гемоглобін переносить кисень від альвеол легенів до тканин.
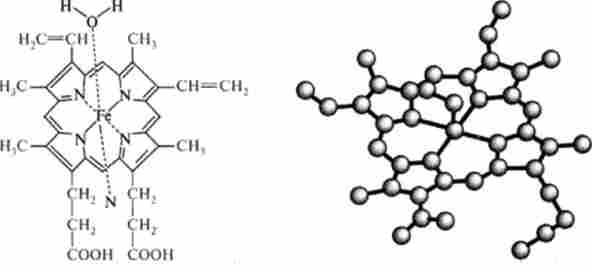
Мал. 3.16. будова гема
Вага гемоглобіни незалежно від джерела отримання утворюють четвертинних структуру і складаються з чотирьох субодиниць, що представляють дві ідентичні пари типу: а2р2. Цікаво відзначити, що а- і p-ланцюга мають високу (більше 50%) ступінь гомології. Чотири поліпептидних ланцюги утворюють тетраедр, структура якого стабілізована множинними нековалентними зв'язками. Кожна поліпептидний ланцюг певним чином покладена навколо плоского кільця гема, причому характер цієї укладання досить консервативний, т. З. майже однаковий для всіх гемоглобинов. Первинна структура гемоглобіну була розшифрована в 1962 р Г. Браунітцером, а просторова структура М. Перутца і співавторами роком раніше. У ссавців а-це- пі гемоглобіну відрізняються від (3-ланцюгів як за кількістю амінокислотних залишків, так і але ступеня гомології (відмінності приблизно по 80 амінокислот). Гем локалізована в складках а- і р-субодиниць, кожна поліпептидний ланцюг при цьому містить один гем. тетрамера гемоглобіну являє собою майже правильну глобулярную структуру розміром 64 х 60 х 50 нм, на поверхні якої в гідрофобних поглибленнях розташовані геми.
Ідентичні субодиниці в тетрамере розташовані паралельно один одному і майже перпендикулярно по відношенню до іншої пари субодиниць. Приєднання гема до Глобино викликає зміни в структурі останнього, причому збільшується ступінь спирализации, формуються додаткові зв'язки між окремими субодиницями, т. Е. Макромолекула стає більш стабільною. Зв'язки між ідентичними субодиниця, як правило, неполярні, хоча спостерігаються поодинокі сольові містки. Освіта зв'язків в гемоглобіні має оборотний характер, причому приєднання до заліза гема того чи іншого ліганда також впливає на здатність а- і p-ланцюгів контактувати один з одним. Так, якщо а, -субодиниці вважати фіксованою в просторі, то а2-ланцюг при приєднанні ліганду повертається на 16 ° і зсувається на 2,1 нм; р2-субодиниця повертається на 13,5 ° і зміщується на 1,9 нм. При приєднанні молекули кисню до гемоглобіну відбувається ряд істотних структурних перебудов останнього, що полегшують приєднання наступних молекул кисню. У дезоксігемоглобіне залізо не знаходиться строго в площині піррольних кілець, а зміщене на 0,25 нм. Молекула кисню після контакту з гемоглобіном проникає всередину гемінових кишені і взаємодіє з залізом. В результаті залізо гема переміщається точно в площину протопорфірінового кільця, що призводить до відповідного змішання гистидинового залишку, з'єднаного з залізом, і всієї поліпептід- ної ланцюга, в якій він локалізований. Зміни в одній субодиниці молекули гемоглобіну зумовлюють відповідні зміни інших субодиниць, вигідні для приєднання молекул кисню. Таким чином, приєднання першої молекули кисню відбувається досить повільно і обов'язково при високому парціальному тиску кисню, що і має місце в альвеолах легенів. Далі швидкість приєднання кисню до гемоглобіну збільшується по наростаючій і швидкість приєднання четвертої його молекули вище, ніж першої, більш ніж в 300 разів. Таким чином, реалізується спільний ефект взаємодії гемоглобіну з киснем, що забезпечує максимальне освіту оксигемоглобина. Четвертичная структура дезоксигемоглобина позначається як Т-форма (Tense - напружена), а структура оксигемоглобина - як R-форма (Relaxed - релаксувати). Міоглобін, що складається з однієї поліпсптідной ланцюга, також приєднує кисень в тканинах, однак відсутність четвертичной структури є перешкодою для реалізації кооперативного ефекту, тому криві насичення гемоглобіну і міоглобіну мають різну форму (рис. 3.17).
Парціальний тиск кисню максимально в легких і мінімально в інших різних тканинах організму. З представлених кривих (рис. 3.17) видно, що спорідненість міоглобіну до кисню вище, ніж гемоглобіну. Наступна відмінність полягає в тому, що крива насичення киснем в разі міоглобіну має гіперболічний форму, а для гемоглобіну - сігмоідную.
Здатність гемоглобіну зв'язувати кисень залежить від ряду факторів. Було виявлено, зокрема, що на зв'язування гемоглобіном кисню великий вплив робить pH середовища і зміст С02. У тканинах, де значення pH дещо менше в порівнянні з легкими, а концентрація С02 досить висока, спорідненість гемоглобіну до кисню знижується, кисень відділяється, а С02 і протон водню приєднуються до гемоглобіну. Навпаки, в альвеолах легенів при звільненні С02 відбувається підвищення pH і спорідненість гемоглобіну до кисню збільшується (рис. 3.18). Цей феномен називається еф<ректом Бора в честь вченого, що вперше відкрив це явище. В реалізації даного ефекту крім гемоглобіну і кисню беруть участь С02 і протон водню. Дезоксигемоглобін є прото лося форму пігменту. Реакцію оксигенації можна записати в такий спосіб:

причому напрямок реакції залежить від концентрації іонів водню. В еритроцитах присутній ще один регулятор спорідненості гем глобина до кисло
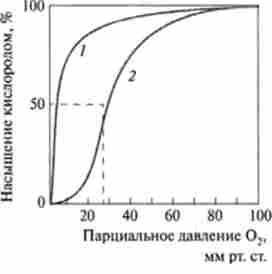
Мал. 3.17. Криві насичення киснем:
/ - міоглобін; 2 гемоглобін
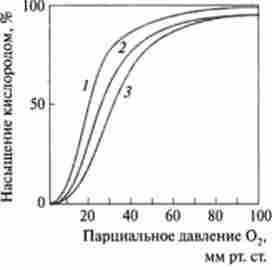
Мал. 3.18. Вплив pH на спорідненість кисню до гемоглобіну:
/ - pH 7,6; 2 - pH 7.4; 3 - pH 7,2 (при pH 7.2. характерному для тканин, спорідненість кисню до гемоглобіну помітно менше, ніж в легенях, для яких pH одно 7,6)
роду. Це 2,3-дифосфоглицерата, який вибірково взаємодіє з дез- оксигемоглобіном, що призводить до стабілізації його структури, а саме Т-форми. Це, в свою чергу, знижує спорідненість до кисню і сприяє його вивільненню при більш низькому парціальному тиску.