| Головна |
| «« | ЗМІСТ | »» |
|---|
В даний час з'ясовано основні реакції освіти тетрапір- ролів, що є безпосередніми попередниками гема і хлорофілу. За допомогою мічених атомів було показано, що в синтезі гема в безклітинних екстрактах еритроцитів птахів беруть участь два вихідних реагенту: амінокислота гліцин і сукцинил-КоА (або активна форма бурштинової кислоти) - проміжний метаболіт циклу трикарбонових кислот. Джерелом чотирьох атомів азоту і восьми атомів вуглецю тетрапіррольних кільця є гліцин, інші атоми вуглецю утворюються з сукці- Ніл-КоА.
Послідовність хімічних реакцій синтезу тетрапірролов в організмі тварин можна умовно розділити на наступні стадії.
У першій стадії, що протікає в два етапи, сукцинил-КоА взаємодіє з гліцином з утворенням б-аминолевулиновой кислоти (б-АЛК):
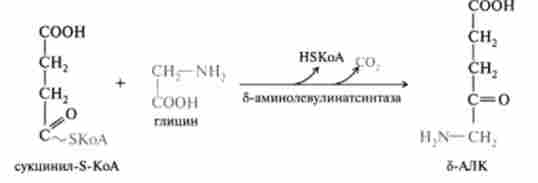
Цю стадію каталізує пірідоксальфосфатзавісімий фермент б-амі- нолевулінатсінтаза - регуляторний фермент синтезу тетрапірролов у всіх живих організмах.
У другій стадії має місце межмолекулярная конденсація двох молекул 5-аминолевулиновой кислоти з утворенням порфобилиногена (ПБГ), заміщеного пиррола:
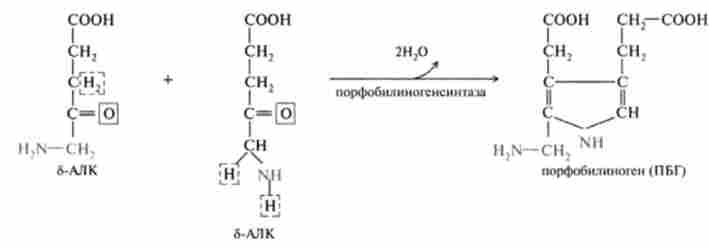
Фермент, що каталізує цю стадію, порфобіліногенсінтаза також є регуляторним ферментом, інгібіруемая кінцевими продуктами синтезу.
Наступна стадія зводиться до конденсації чотирьох монопіррольних молекул порфобилиногена з утворенням тетрапіррольних комплексу прото порфирина IX. що є безпосереднім попередником гема.
Перетворення порфобилиногена в порфирин представляє складний багатостадійний процес, багато деталей якого ще не ясні (рис. 25.2). Як показано на рис. 25.2, під дією двох ферментів - уропорфіріноген I- синтази (УПГ I-синтаза) і уропорфіріноген Ш-косінтази (УПГ Ш-косін- таза) синтезується специфічний ізомер циклічного тетрапіррола, званий уропорфіріногеном III. Після цього в результаті хімічної модифікації бічних радикалів, окислювально-відновних перетворень утворюються різні види порфиринов. Слід зазначити, що порфіріногени безбарвні в порівнянні з пофарбованими порфиринами, так як у них немає пов'язаною системи і вони містять шість додаткових атомів водню.
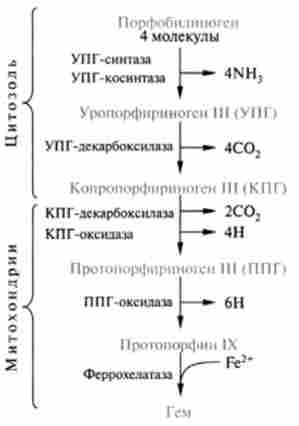
Мал. 25.2. Основні стадії синтезу гема з порфобилиногена
На заключній стадії протопорфі- рин IX приєднує молекулу заліза за участю гемсінтетази (або феррохелатази) і утворюється гем. Джерелом заліза в цій реакції є білок феритин, який депонує залізо; в найбільших кількостях він відкладається в клітинах кісткового мозку, печінки, селезінки.
Ферритин - це великий олігомерного білок, що складається з 24 ідентичних протомеров, молекулярна маса -450 kDa. Протомери феритину утворюють сферичну структуру, всередині якої є порожнина.
Іони заліза через канали в білкової «оболонці» проникають в порожнину, утворюючи «залізне» ядро в молекулі феритину. Надлишок заліза в ретикулоендотеліальних клітинах печінки і селезінки може депонуватися в гемосидерині, який на відміну від феритину є водонерозчинних железосодержащим комплексом. Частина заліза, необхідного для синтезу гема, компенсується його надходженням з їжею. Перенесення заліза з потоком крові до місць депонування і використання здійснюється водорозчинних білком плазми крові трансферрином. Він має два центри зв'язування заліза, яке в комплексі з білками знаходиться в трехвалентном стані, однак при переході заліза від одного білка до іншого його валентність щоразу змінюється двічі: Fe3+, Fe2+ і знову Fe3+. В окисно-відновних перетвореннях заліза беруть участь, по-видимому, самі білки-переносчі- ки, а також медьсодержащий білок церулоплазмін, присутній в сироватці крові (див. Рис. 25.1). Вважають, що зміна валентності заліза необхідно для його звільнення з з'єднання з одним білком і перенесення на інший.
Слід звернути увагу, що реакції синтезу гема протікають як в цитоплазмі клітини, гак і в мітохондріях. Так, амінолевулінсінтетаза знаходиться в мітохондріях, де і починається синтез гема, синтез же порфобилиногена і вага наступні перетворення до освіти копропорфіріногена III протікають в цитоплазмі клітин. Копропорфіріноген III далі надходить в мітохондрії, де і завершується синтез гема.