| Головна |
| «« | ЗМІСТ | »» |
|---|
Реакцію гібридизації використовують в генетичної інженерії для створення гібридних молекул ДНК, а також як ефективний метод для виявлення певних послідовностей в ДНК і РНК. Якщо водний розчин ДНК нагріти до температури 96-100 ° С і сильно защелочіть (pH> 13,0), то ДНК дисоціює на окремі ланцюги. цей процес денатурації ДНК звернемо, оскільки якщо дві ізольовані ланцюга ДНК витримувати певний час при 65 ° С, то вони знову спаровуються, утворюючи подвійну спіраль, що і називають ренатурацією, або гибридизацией (відпалом). Гібридизація може йти між одинарними ланцюгами ДНК і / або РНК (звичайно, якщо вони мають комплементарні послідовності нуклеотидів), що призводить до утворення подвійних ланцюгів (дуплексів) різного складу: ДНК: ДНК; РНК: РНК; ДНК: РНК.
При конструюванні гібридних ДНК гібридизація нуклеїнових кислот реалізується як правило в двох основних стратегіях (методах) отримання рекомбінантних ДНК: коннекторние і рестріктазного-лігазну.
коннекторние метод (Рис. 15.2) створює умови для гібридизації продуктів рестрикції різних геномів шляхом нарощування на їх кінцях комплементарних олігонуклеотидних ділянок. Гібридизація (отжиг) цих ферментів веде до утворення гібридних молекул ДНК. У цьому методі використовують 3 ферменту: 5'-екзонуклеаза, термінальну нуклеотіділ- трансферазу і ДНК-лігази. Саме цим методом П. Берг і співробітники отримали в 1972 р першу гібридну молекулу ДНК.
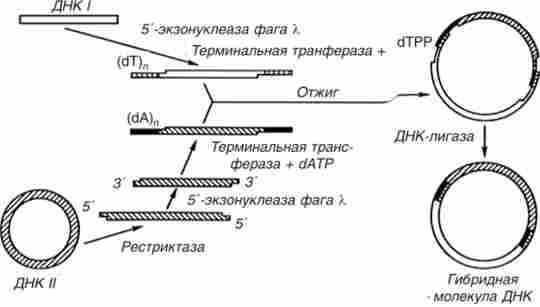
Мал. 15.2. Схема контрольного методу отримання гібридних молекул ДНК
Рестріктазного-лігазну метод (Рис. 15.3) найбільш простий і популярний в генетичній інженерії. У цьому методі з використанням однієї рестріктази II, що дає фрагменти рестрикції з «липкими кінцями», гібридизація між фрагментами хромосомної ДНК і ДНК-плазмидой здійснюється без додаткової процедури нарощування комплементарних кінців. Після закінчення гібридизації залишається тільки зшити полі- нуклеотидні фрагменти за допомогою ДНК-лігази.
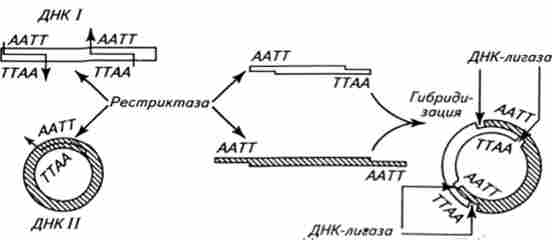
Мал. 15.3. Схема рестріктазного-лігазну методу отримання гібридних молекул ДНК
Гібридизацію використовують для знаходження числа певних нуклеотидних послідовностей (генів) в ДНК. Для цієї мети застосовують ДНК -зонди - радіоактивні фрагменти ДНК з відомою нуклеотидної послідовністю. Мітку в зонд вводять шляхом нік-трансляції. Це дуже точний метод, який дозволяє виявити один ген в клітці. Так виявляють окремі (унікальні гени), а також гени, представлені в геномі десятками або сотнями копій.
Для локалізації специфічних послідовностей нуклеїнових кислот в хромосомах і клітинах використовують гібридизацію in situ. При цьому ДНК-зонди гибрідизуючою з хромосомами після короткочасного впливу лугом. Далі місця гібридизації виявляють за допомогою радиоавтографии. Застосовують не тільки радіоактивні, а й хімічно мічені ДНК-зонди. Для цього при синтезі зонда використовують нуклеотиди, що містять бічну ланцюг біотину, яку після гібридизації забарвлюють стрептовідіном. За допомогою гібридизації in situ можна виявити локалізацію певних видів мРНК в клітинах і таким чином судити про диференціювання в клітинах ембріона. Популярною біологічної моделлю таких досліджень є ембріони плодової мушки дрозофіли.
Гібридизацію використовують для виявлення транскрібіруемих і не- транскрібіруемих послідовностей в ДНК. При цьому аналізуються продукти гібридизації ДНК і матричних РНК, що дозволяє виявити активні (транскрібіруемих) ділянки в молекулах ДНК.
Гібридизація широко використовується для виявлення певних нуклеотидних послідовностей в суміші рестрикційних фрагментів. Такий прийом носить назву блот (Від англ, blot - промокати). Рестрикційні фрагменти фракционируют методом електрофорезу (застосовують високошвидкісне центрифугування в градієнті щільності CsCl з використанням етидія броміду). Це дозволяє розділити до 500 фрагментів, що відрізняються за розмірами всього на один нуклеотид. Потім гель агарозу поєднують з листом нітроцелюлозній паперу. В результаті дифузії фрагменти частково переходять на цей лист, і таким чином виходить відбиток (репліка) з гелю. Потім методом радиоавтографии з використанням радіоактивного ДНК-зонда визначають на репліці положення фрагментів, які гибрідизуючою з зондом.
Полімеразна ланцюгова реакція (ПЛР) - це метод ампліфікації (від лат. ampliticatio - поширення, збільшення) фрагментів нуклеїнових кислот in vitro. З його допомогою можна досить швидко отримати мільйони копій сегментів ДНК або РНК, навіть коли вони присутні в препараті у вигляді єдиної молекули.
Вся полімеразна ланцюгова реакція здійснюється in vitro з використанням ДНК-полімерази і олігонуклеотидних праймерів, комплементарних двом З'-кінців ділянок, що обмежують ампліфіціруемого двобічний сегмент. Для здійснення реакції необхідно знати нуклеотидну послідовність тієї ділянки, яка бажано ампліфікувати, щоб можна було синтезувати відповідні олігонуклеотидних праймери.
У методі ПЛР для ампліфікації фрагментів ДНК використовують термоустойчивую ДНК-полімерази з термофільної бактерії Thermus aquaticus (7ад-полімерази), яка в присутності всіх чотирьох видів нуклеотидів і коротких 20-30-членних запалів (праймерів) здійснює синтез комплементарних послідовностей ДНК.
Спочатку здійснюють термічну денатурацію (розплітання) двухцепочечной молекули (фрагмента) ДНК при 93-95 "С, що призводить до поділу комплементарних ланцюгів. Після цього проби охолоджують до 60 ° С, що дає можливість зв'язатися праймерів і одноланцюговим дезоксіоліго- нуклеотидам, а Гад-полімерази - включитися в роботу.
Праймери зазвичай отримують методом хімічного синтезу, визначивши попередньо нуклеотидную послідовність прикордонних з ампліфіціруемого геном ділянок ДНК. Праймери підлаштовуються самі (по комплементарному принципом) до денатурований нагріванням гомологічним ділянкам одноланцюгових фрагментів вихідної «материнської») ДНК. Вони служать, по суті, для двох цілей: по-перше, запускають роботу ДНК-полімерази, по-друге, обмежують її дію, як би застопорівают фермент в рамках потрібної ділянки копіювання ДНК.
ПЛР має циклічний характер (рис. 15.4). У першому і частково у другому циклах утворюються копії (амплікона) ДНК не відповідають кордонів амплифицируемого гена (всі амплікона в першому циклі і частина амплікон в другому циклі виходять більш протяжними в тих ділянках, де ще не відбулося зв'язування другого - «антисмислового» - праймера) . Однак починаючи вже з третього циклу довжина амплікон стає стандартною, т. Е. Відповідає числу пар нуклеотидів фрагментів ДНК-матриці між З'-кінцями праймерів. Амплікона накопичуються в геометричній прогресії і починають домінувати серед продуктів ампліфікації. Процес має ланцюговий характер, т. К. Синтезовані фрагменти ДНК в подальшому самі служать матрицею, на якій йде синтез.
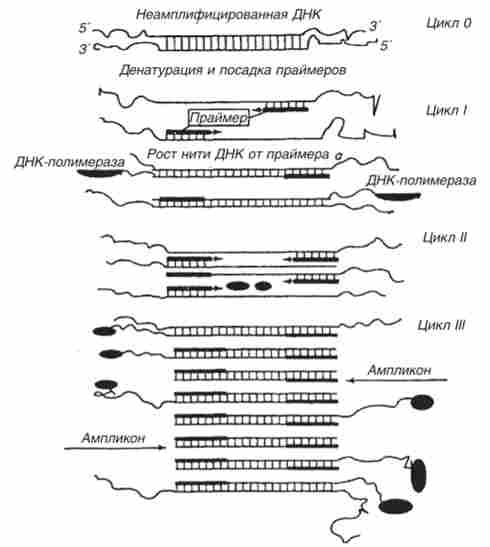
Мал. 15.4. Схема полімеразної ланцюгової реакції (ПЛР)
При багаторазовому повторенні циклів синтезу (що включають нагрівання та охолодження проб в вищеназваних межах температур) число копій специфічних фрагментів ДНК експоненціально збільшується. Це дозволяє з невеликого числа наявних фрагментів отримати безліч копій, які можна ідентифікувати методом електрофорезу. Повторюючи цикли ампліфікації 30-40 разів, за 1,5-3 год отримують мільйони копій фрагментів ДНК.
Результати, що досягаються за допомогою ПЛР, дозволили цим методом зайняти провідне місце в молекулярної біології як за популярністю використання в наукових дослідженнях фундаментального характеру, так і з практичного застосування в медичних цілях.
Дуже важливо застосування ПЛР при визначенні характеру мутацій. Після того як ген клонований, за допомогою двох праймерів ампліфіціру- ють відповідний геномної сегмент, отриманий від різних особин даного виду. Секвенування цього сегмента дозволяє встановити природу мутації, що сталася в даному гені, або виявити поліморфізм, будь то заміна однієї пари підстав або делеція, инсерция або перебудова. Завдяки простоті методу з його допомогою можна діагностувати генетичні захворювання і проводити популяційно-генетичні дослідження.