
| Головна |
| «« | ЗМІСТ | »» |
|---|
Багато електроліти, зокрема гідроксиди різних елементів Е, проявляють властивості кислот або підстав.
Дисоціація гідроксиду ЗОН може протікати за двома типами:

т. е. розрив може відбуватися по обидва зв'язків групи Е-О-Н.
Наприклад, оцтова кислота
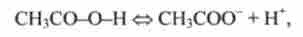
луг
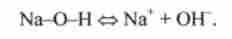
При порівнянній міцності зв'язків О-Н і Е-О дисоціація одночасно може протікати по кислотному і основному типам:
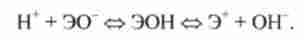
Гідроксиди такого типу називаються амфоліти. До амфоліти відноситься вода Н20:

В даний час не існує однозначного визначення понять кислоти і підстави, яке в рівній мірі можна було б використовувати для характеристики кислотно-основних властивостей речовини в будь-яких розчинниках.
Для характеристики багатьох електролітів у водних розчинах і в даний час можна використовувати поняття кислоти, підстави, дані Арреніус:
Кислотою називають електроліт, дисоціюють в розчинах з утворенням водень-іонів Н +;
підставою називають електроліт, дисоціюють в розчинах з утворенням гідроксид-іонів ОН;
амфолітом (амфотерним гідроксидом) називають електроліт, дисоціюють в розчині з утворенням як водень-іонів, так і гідроксид-іонів.
До амфоліти відносять амінокислоти, білки, нуклеїнові кислоти, а також гідроксиди цинку, алюмінію, хрому та інших амфотерних елементів.
У кислому середовищі амфоліт проявляє основний, а в лужному середовищі - кислотний характер.
Наприклад, гідроксид цинку при взаємодії з кислотами поводиться як підстава:
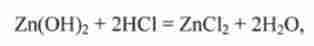
а при взаємодії з лугами - як кислота H2Zn02:

Таким чином, відповідно до теорії Арреніуса властивості кислот обумовлені наявністю в їх розчинах водень-іонів, а властивості підстав - присутністю в їх розчинах гідроксид-іонів. Однак такий погляд на кислоти і підстави застосуємо тільки для водних розчинів.
Обмеженість понять кислоти і підстави, даних Арреніус, можна проілюструвати прикладами. молекула NH3 не містить іона ОН, а молекула СО? - іона Н ', проте в водному розчині перша проявляє властивості основи, а друга - кислоти.
Дослідження подібного типу реакцій, і в особливості реакцій, що протікають в наведених розчинниках, привело до створення більш загальних теорій кислот і підстав.
У 1923 р І. Бренстед і Т. Лоурі розробили протонну теорію кислот і підстав. Відповідно до неї,
кислотою називають будь-яка речовина, молекулярні частинки якого (в тому числі і іони) здатні віддавати протон, т. е. бути донором протонів; підставою називають будь-яка речовина, молекулярні частинки якого (в тому числі і іони) здатні приєднувати протони, т. е. бути акцептором протонів.
Такі визначення кислот і підстав дозволяють включати в їх число не тільки молекули, але і іони. Наприклад, карбонат-іон згідно протонної теорії є підставою, гак як у водному розчині він приєднує протон: СО / + Н+ про оНСО з. Відповідно до протонної теорією кислоти поділяють на три типи:
1) нейтральні кислоти, наприклад НС1, H2SO4, Н3РО4:
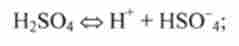
2) катіонні кислоти, що представляють собою позитивні іони, наприклад NH%. НЗО+:
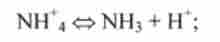
3) аніонні кислоти, що представляють собою негативні іони, наприклад HSO 4, Н2РВ 4, НРО2 4:
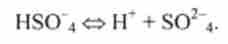
Подібного типу класифікація є і для підстав:
1) нейтральні підстави, наприклад NH3, Н2О, С2Н5ОН:
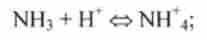
2) аніонні підстави, що представляють собою негативні іони, наприклад СГ, СНзСОО, ОН ":
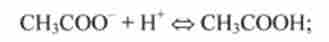
3) катіонні підстави, що представляють собою позитивні іони, наприклад h2n-nhV
Розчинники типу води, рідкого аміаку, а також аніони многоосновних кислот, які можуть бути і донорами і акцепторами протонів, є амфоліти.
Так, в реакції
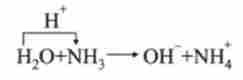
молекула води віддає протон і є кислотою. Однак в реакції
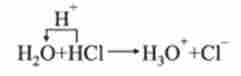
молекула води приєднує протон і є підставою. Таким чином, вода - типовий амфоліт.
Процес дисоціації (іонізації) речовини відбувається в контакті з розчинником. При цьому розчинник виконує або функцію кислоти, або функцію підстави.
Наприклад, при розчиненні аміаку вода - кислота:
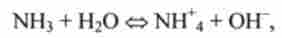 при розчиненні НС1 вода - основа:
при розчиненні НС1 вода - основа:
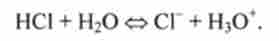
Згідно протонної теорії, віддаючи протон, кислота перетворюється в основу, яке називають зв'язаним цієї кислоті. Таким чином, можливі наступні варіанти.
I. (Кислота) <=> (поєднане підставу) | + Н,
т. е. кожної кислоті відповідає поєднане підставу.
Навпаки, підстава, приєднуючи протон, перетворюється в пов'язану кислоту.
II. {Підстава)2 + Н <=> {Сполучена кислота)}.
Наприклад, кислоті СН3СООН відповідає поєднане підставу СН3СОО, основи СГ - сполучена кислота НС1.
Так як протон в розчинах не існує у вільному вигляді, кислота може віддати протон тільки підставі, що, прийнявши протон, стає кислотою. Тому згідно протонної теорії має місце кислотно-лужний (КО) рівновагу, обумовлене переносом протона:
III. {Кислота) J + (підстава) г про {Кислота)} + {Підстава).
Для стислості оборотний процес кислотно-основної взаємодії називають КО-рівновагою.
наприклад:

Реакції нейтралізації, іонізації, гідролізу з точки зору протонної теорії є окремими випадками КО-рівноваг.
Реакція I типу СН3СООН + Н2О <=> СН3СОО + Н30 протікає в прямому напрямку, являє собою іонізацію оцтової кислоти, в зворотному ж напрямку - нейтралізацію будь-якого ацетату, наприклад ацетату натрію, сильною кислотою.
Реакція II типу NH% + Н2О <=> NH3 + Н3О *, що протікає в прямому напрямку, показує гідроліз будь-якої солі амонію, а в зворотному напрямку - нейтралізацію аміаку сильною кислотою.
У цих кислотно-основних равновесиях вода відіграє роль підстави. Але, будучи амфолітом в інших кислотно-основних равновесиях, вона може виконувати і роль кислоти, наприклад:
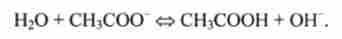
Тут пряма реакція кислотно-лужної рівноваги представляє гідроліз ацетату, а зворотна - реакцію нейтралізації оцтової кислоти сильною основою.
Протолітичні кислотно-основні рівноваги III типу можуть мати місце не тільки у воді, але і в інших розчинниках, наприклад в безводному HF:
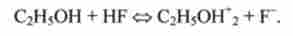
Дисоціація води відповідно до теорії Бренстеда протікає по рівнянню
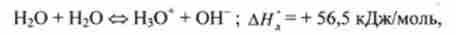
т. е. одна молекула води віддає, а інша - приєднує протон, відбувається автоіонізації води.
Константа дисоціації води при 298 К, певна методом електричної провідності, дорівнює:
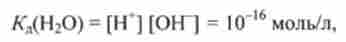
де [Н *], [ОН], [НДО] - концентрації іонів Н ОН "і води (для стислості замість НЗО ~ в кислотно-основних равновесиях пишуть Н).
Ступінь дисоціації води дуже мала (дуже слабкий електроліт), тому активність водень і гідроксид-іонів у чистій воді практично дорівнює їх концентрації. Так як вода присутня у великому надлишку, її концентрація може вважатися постійною. Вона становить 55,6 моль / л (1000 г: 18 г / моль = 55,6 моль). Підставляючи у вираз для константи дисоціації / Сл(Н20) це значення, отримують нове вираз:
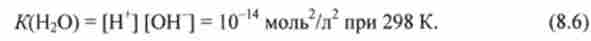
Константа / С (Н20) називається іонним твором або константою автоіонізації води.
Згідно зі слів (8.6),
-^ В чистій воді або будь-якому водному розчині при постійній температурі твір концентрацій (активностей) водень і гідроксид-іонів є величина постійна, звана іонним твором води.
Константа / Г (Н20) залежить від температу ри. При підвищенні температури вона збільшується, так як процес дисоціації води ендотермічний: АЯ "= = + 56,5 кДж / моль (принцип Ле Шательє). Так, при температурі тіла людини (310 К) константа До (Н20) = 3,13 * 10 14, а при температурі 373 К зростає до 5,9-1 (Г13.
У чистій воді при 298 К концентрації іонів Н+, ВІН "рівні [Н] = = [ОН] = 1 -10-7 моль / л, як це випливає з рівності (8.6).
У розчинах різних речовин відповідно до закону діючих мас константа До (Н20) має те ж значення, що і для чистої води.
Розчини, в яких [Н+] = [ОН-], Називають нейтральними.
Якщо до чистої води додати стільки лугу, щоб концентрація гідроксід- іонів підвищилася, наприклад, до 10 4 моль / л, то, по Лешательє, рівновагу дисоціації води зміститься і концентрація [Н *] знизиться до 10 "ш моль / л, так що за законом діючих мас іонний добуток води залишиться рівним КГ14 моль2/ л2.
Навпаки, якщо до чистої води додати стільки кислоти, щоб концентрація водень-іонів підвищилася, наприклад, до 10-? моль / л, то концентрація гідроксід- іонів знизиться до 10 "моль / л і іонний добуток води знову стане рівним
КГ14 моль2/ л2.
З цих прикладів видно, що концентрації (точніше, активності) гідроксід- і водень-іонів взаємозалежні. Знаючи концентрацію одного з цих іонів, завжди можна розрахувати концентрацію іншого. Тому кислотність і лужність розчину можна оцінити кількісно концентрацією одного з цих іонів.
Як характеристики кислій реакції середовища часто використовують концентрації водень-іонів, але на практиці це не дуже зручно. Тому зазвичай для цієї мети використовують негативний десятковий логарифм концентрації водень-іонів, званий водневим показником pH середовища (pH від англ, power Hydrogene - сила водню):
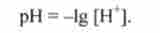
Наприклад, якщо [Н+] = 10 "? моль / л (кисле середовище), то pH = 3, а якщо [Н *] = 10 9 моль / л (лужне середовище), то pH = 9. У нейтральному середовищі [Н4] = 10_г моль / л і pH = 7.
З цих прикладів слід, що в нейтральному середовищі [Н4] = 10 ~7 моль / л, pH = 7,0; в кислому середовищі [Н+] > 10 "7 моль / л, pH < 7,0; в лужному середовищі [Н] < 10 "7 моль / л, pH > 7,0.
Реакцію середовища можна охарактеризувати і гідроксильних показником, т. Е. Негативним десятковим логарифмом концентрації гідроксид-іонів:
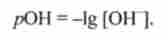
Якщо взяти негативний десятковий логарифм виразу іонного добутку води, отримаємо
або
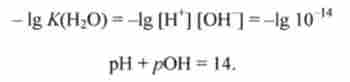
У розчинах сильних кислот і підстав pH показники кислотності і основності можуть бути розраховані за формулами
pH = -lg з (Кислота); / ЮН = -lg з (підставу).
У розчинах слабких кислот НА кислотно-основну рівновагу III типу має вигляд
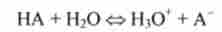
або
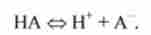
Константа кислотної дисоціації Доа дорівнює
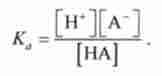
Тут [Н ~] = [А], тому що відповідно до реакції при дисоціації НА утворюється один іон Н і один іон А. [НА] = с (НА) - [Н '], де с (НА) - вихідна концентрація кислоти при її розчиненні. Підставляючи це значення в рівняння для Kq, при с (НА), що дорівнює або більше 0,01, отримують вираз для розрахунку концентрації водень-іонів в розчині слабкої кислоти:
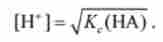
Взявши негативний десятковий логарифм обох частин цього рівняння, отримують
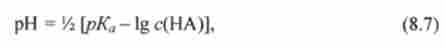
де рКа = -lg Доа.
У розчиніслабких підстав В кислотно-основну рівновагу III типу має вигляд
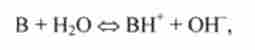
де В - підстава, а ВН+ - сполучена У кислота. Константа основності (КО) рівноваги в цьому випадку відповідно до закону діючих мас дорівнює

константу кь називають константою дисоціації підстави В. Наприклад, коли при дисоціації утворюються гідроксид-іони
то
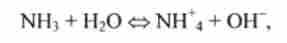
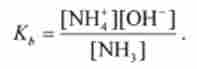
Відповідно до теорії Бренстеда основи В відповідає сполучена кислота ВН Тому сила підстави у водному розчині може визначатися і константою кислотної дисоціації сполученої кислоти.
Дійсно, константа кислотної дисоціації Доа для сполученої кислоти ВН "дорівнює

Наприклад, для дисоціації амоній-іона
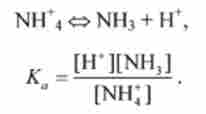 Перемножая вираження для Доа і кь » отримують
Перемножая вираження для Доа і кь » отримують
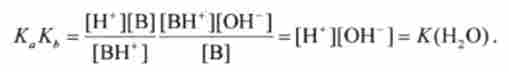
Таким чином, величини Доа і кь для сполученої кислотно-основної пари пов'язані простим співвідношенням (Т = 298 К):
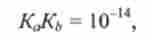
або
або
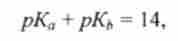
звідси

Таким чином, сила кислот і підстав може бути виражена в загальній шкалі значень рКа, подібно до того, як реакція середовища характеризується водневим показником pH.