| Головна |
| «« | ЗМІСТ | »» |
|---|
Біологічні рідини і тканини містять багато різних електролітів: NaCI, КО, АЛЕ, СаС12, NaH2P04, NaHCOj і ін. Стійкість біологічних високомолекулярних сполук і швидкість багатьох біохімічних реакцій в значній мірі залежить від природи і концентрації присутніх в рідинах і тканинах іонів. Поведінка іонів в складних біологічних системах, якими є живі організми, визначається викладеними вище закономірностями.
Організм людини постійно втрачає воду: частково з потом, частково через легені, але в основному шляхом виділення сечі. При цьому з сечею і потім втрачається значна кількість електролітів (в основному неорганічних солей). Концентрація іонів в тканинах підтримується приблизно постійною (іонний гомеостаз), тому надходження і виділення солей тісно пов'язані з обміном води.
При тривалій жадобі обсяг позаклітинного простору тканин зменшується за рахунок зменшення кількості води. Це призводить до збільшення концентрації іонів. Для компенсації підвищення осмотичного тиску з сечею видаляються іони Na "і СГ. Якщо і надалі вода нс надходить в організм, в сечі з'являються іони К *. Це вказує на скорочення внутрішньоклітинного простору, внаслідок чого клітини віддають свої іони. Паралельно зменшується обсяг плазми крові , підвищується концентрація електролітів і відбувається «згущення» крові.
Якщо в результаті якихось захворювань виділяється сеча з підвищеним вмістом солей, то разом з сіллю організм втрачає і воду. При цьому зменшується концентрація іонів в плазмі крові, що призводить до зниження тиску крові.
Процеси ресорбции (зворотне всмоктування) води і іонів (Na ', К', СГ) незалежні один від одного. Тому зрушення концентрацій, що виникають в результаті мінливості співвідношення введеної кількості води і солей, усуваються нирками шляхом зміни ресорбции відповідних іонів або води.
При нестачі солей в організмі обсяг позаклітинного простору також зменшується, оскільки організм не в змозі заповнити його фізіологічним розчином. Тому для підтримання сталості осмотичного тиску в позаклітинному просторі втрата солей супроводжується виведенням води.
Таким чином, концентрація іонів регулює розподіл води між позаклітинним простором і клітинами тканин, а також між позаклітинним простором і сечею.
Кислотно-лужну рівновагу в крові і біорідинах визначається вмістом слабких і сильних електролітів: Na2HP04, NaH2P04, H2C03, NaHC03. Для розуміння механізму дії цих речовин необхідне знання їх констант дисоціації. Особливо істотно це для розрахунку фосфатного балансу при навантаженнях.
Іони відіграють визначальну роль у створенні осмотичного тиску різних біологічних рідин. Особливості метаболічного обміну іонів мають велике значення для життєдіяльності організму. Так, наприклад, обмін іонів К * важливий для роботи нервових і м'язових клітин. Надходження цих іонів при нормальному харчуванні відбувається постійно. Але, так як вони віддаляються нирками, їх концентрація в плазмі не підвищується, поки нирки працюють нормально. Зменшення концентрації іонів К * всередині клітин може призвести до захворювання, відомому під назвою періодичного паралічу. Сутність захворювання полягає в періодичному появі паралічів внаслідок зниження рівня іонів К * в крові і, отже, в клітинах. При відновленні нормального змісту іонів калію в крові параліч проходить.
До багатокомпонентним розчинів високомолекулярних сполук (ВМС), які містяться в живих організмах, може бути застосована теорія сильних електролітів. Так, наприклад, можна використовувати безпосередньо для визначення розчинності білків граничний закон Дебая-Хюккеля.
Для виділення і очистки білків використовують метод осадження шляхом додавання до розчину білка солі (висолювання). Виявилося, що осадження (висолювання) ВМС в концентрованих розчинах солей добре описується на основі закону Дебая-Хюккеля, математичне вираження якого в цьому випадку має такий вигляд:
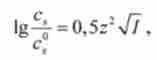
де зя і С® - розчинність ВМС в сольовому і безсольових (/ = 0) розчинах відповідно; / - іонна сила.
Іонна сила розчину дорівнює
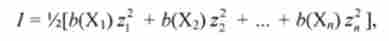
де / - іонна сила; /> (Х |), 6 (ХГ) і т. Д молекулярний концентрації іонів Х |, ХГ і т. Д .; z9 22 ...- заряди іонів Х |, Х2 і т. Д.
Очевидно, що рівняння (8.6) для розчинів ВМС є аналогом закону Сеченова (8.2) для розчинності газів, так як зі співвідношення (8.6) слід