| Головна |
| «« | ЗМІСТ | »» |
|---|
Рак підшлункової залози (РПЖ) - одне з найбільш поширених і важко виліковних онкологічних захворювань. Резектабельность (можливість виконання резекції у госпіталізованих хворих) рідко перевищує 20%. Госпітальна летальність серед радикально оперованих в спеціалізованих клініках рідко перевищує 5%; разом з тим п'ятирічне виживання після резекції ПЖ з приводу раку, як правило, дуже низька і становить всього 5-8%.
Рак ноджелудной залози займає в розвинених країнах 4-5-е місце серед причин смерті від онкологічних захворювань, причому на нього припадає близько 10% всіх пухлин травної системи. Чоловіки хворіють в 1,5 рази частіше, ніж жінки, пік захворюваності припадає на вік 60-70 років. У США щороку виявляються 11 нових захворювань на 100 тис. Чоловік населення, в Англії і Японії - 16, в Італії та Швеції - 18. У Росії захворюваність на рак ПЖ становить 8,6 на 100 тис. Жителів, в Москві - 11,4 , а в Санкт-Петербурзі - 14,8 на 100 тис. жителів.
Пильна увага до діагностики та лікування раку ПЖ викликано зростанням захворюваності (за останні тридцять років на 30%) і незадовільними результатами лікування - до 90% хворих помирають протягом року після встановлення діагнозу.
Етіологія. Рак підшлункової залози частіше зустрічається серед міських жителів, які вживають велику кількість м'яса і жирів. Куріння сприяє канцерогенезу взагалі і розвитку РПЖ зокрема (у курців захворювання реєструється в 2-2,5 рази частіше, ніж у некурящих). Передбачається, що канцерогени, що містяться в тютюні, можуть за певних умов з жовчю потрапляти в панкреатичний протік, провокуючи спочатку запалення, а потім виникнення пухлини. Вважається, що споживання великої кількості кави (більше трьох чашок в день) підвищує ризик захворювання, але справжні причинно-наслідкові зв'язки залишаються в даному випадку неясними.
Патологічна анатомія. Пухлина ПЖ частіше являє собою аденокарциному, зростаючу з епітелію проток. Рак головки ПЖ зустрічається приблизно в 75% випадків (майже у чверті цих хворих пухлина локалізується в крючковидного відростку), рак тіла і хвоста - в 25% спостережень.
До моменту встановлення діагнозу пухлина майже у половини хворих вже поширюється за межі ПЖ, а у третини виявляються віддалені метастази.
Залежно від первинної локалізації пухлини може відбуватися її інвазія в різні сусідні органи і тканини:
Шляхи метастазування. Як уже згадувалося, РПЖ рано метаста- зірует але лімфатичних шляхах і гематогенно. Уражаються регіонарні лімфатичні вузли: панкреатодуоденальная, ретронілорічні, перипортальні (гепатодуоденальной), неріцеліакальние, мезентеріальні, парааортальні. Гематогенні метастази найчастіше локалізуються в печінці, значно рідше в легенях, плеврі, нирках і т. Д. Нарешті, імплантації метастазування призводить до розвитку канцероматоза очеревини.
Класифікація. При аналізі великого клінічного матеріалу (понад 700 хворих РПЖ) нами було встановлено, що рак крючковидного відростка (КО) підшлункової залози, як правило, відносяться до пухлин головки ПЖ, має деякі клінічні відмінності і особливості хірургічного лікування, про які буде сказано далі. Це послужило підставою для виділення ще однієї локалізації раку підшлункової залози - раку КО, на додаток до раку головки, тіла і хвоста ПЖ.
Гістологічно виділяють аденокарциному, плоскоклітинний рак, цістаденокарцііому, ацинарну рак, недиференційований (анапластічний) рак. Вважається, що у кожного десятого хворого РПЖ розвивається мультіцентрічно.
Поширеність пухлинного процесу оцінюється за системою TNM. Класифікація раку підшлункової залози за системою TNM виглядає наступним чином (див. прим, на с. 19):
- Т - первинна пухлина:
ТХ - недостатньо даних для оцінки первинної пухлини;
ТО - первинна пухлина не визначається;
Tis - нреінвазівная карцинома (Carcinoma in situ);
T1 - пухлина обмежена ПЖ, до 2 см в найбільшому вимірі;
Т2 - пухлина обмежена ПЖ, більше 2 см в найбільшому вимірі;
ТЗ - пухлина поширюється за межі ПЖ, але не залучає чревного або верхню брижових артерію;
Т4 - пухлина поширюється на чревного або верхню брижових артерію;
- N - регіонарні лімфатичні вузли:
NX - недостатньо даних для оцінки регіонарних лімфатичних вузлів;
N0 - немає ознак метастатичного ураження регіонарних лімфатичних вузлів;
N1 - регіонарні лімфатичні вузли вражені метастазами;
- М - віддалені метастази:
MX - недостатньо даних для визначення віддалених метастазів;
МО - немає ознак віддалених метастазів;
М1 - є віддалені метастази.
Угруповання раку ПЖ за стадіями представлена в табл. 21.1.
Таблиця 21.1
Угруповання раку підшлункової залози але стадіями
|
стадія |
характеристика TNM (Див. Прим, на с. 19) |
||
|
первинна пухлина |
регіонарні лімфатичні вузли |
віддалені метастази |
|
|
0 |
Tis |
N0 |
МО |
|
I а |
Т1 |
N0 |
МО |
|
lb |
Т2 |
N0 |
МО |
|
па |
ТЗ |
N0 |
МО |
|
іь |
Т1-3 |
N1 |
МО |
|
III |
Т4 |
Будь-яка N |
МО |
|
IV |
Будь-яка Т |
Будь-яка N |
М1 |
Клінічна картина. Погані результати лікування РПЖ пов'язані перш за все з пізньої його діагностикою. Клінічна картина найчастіше розвивається поступово. Середня тривалість клінічних проявів до встановлення діагнозу становить 2-4 місяці. До основних початковим (в дожелтушного фазі захворювання при раку головки ПЖ), хоча і далеко не раннім, проявам раку ПЖ відносять дискомфорт у верхній частині живота у вигляді відчуття тяжкості і переповнення шлунка, особливо після їжі, а також болі, втрату маси тіла, зниження апетиту і нудоту. Неспецифічність цих симптомів часто стає причиною пізньої діагностики захворювання.
До класичних, хоча зазвичай і більш пізнім, симптомів РПЖ відносяться жовтяниця, втрата маси тіла і біль в животі.
Клінічна картина залежить від локалізації пухлини. Провідними клінічними симптомами раку головки ПЖ виступають жовтяниця, зазвичай з'являється без больового нападу (92-98%), втрата маси тіла (65- 80%) і болю (45-65%). При раку тіла і хвоста найчастіше відзначаються втрата маси тіла (більше 90%) і болю (більше 70%). Разом з тим нами відзначено, що при раку КО, на відміну від раку головки, до якого, як уже згадувалося, його відносять, найбільш частими скаргами хворих виявляються болі (70%) і втрата маси тіла (50%), а жовтяниця зустрічається рідко (близько 15%) і виступає більш пізнім симптомом.
при описі клінічної картини РПЖ нерідко починають з синдрому механічної жовтяниці, так як це найбільш яскравий і частий синдром при раку головки ПЖ, який, як уже зазначалося, зустрічається більш ніж в 70% випадків РПЖ. Механічна жовтяниця нерідко виявляється першим, але, на жаль, не ранньою ознакою, з появою якого захворювання переходить у другу (жовтяничну) фазу. Механічну жовтяницю не завжди легко відрізнити від паренхіматозної, так як в обох випадках зазвичай не розвивається больовий синдром. До 80% хворих з синдромом жовтяниці спочатку госпіталізують в інфекційні стаціонари. При цьому іноді на встановлення характеру жовтяниці витрачається більше чотирьох тижнів, що призводить до розвитку печінкової недостатності, різко погіршує безпосередні результати оперативного лікування і онкологічний прогноз. Жовтяниця відзначається в 90% випадків раку головки ПЖ. Для механічної жовтяниці при раку головки ПЖ характерно неухильне прогресування билирубинемии. Час появи жовтяниці при раку головки ПЖ залежить від близькості пухлини до загального жовчному протоку: чим ближче до нього локалізується пухлина, тим раніше з'являється жовтяниця, і навпаки.
Застій жовчі в жовчовивідної системі сприяє приєднанню інфекції, розвитку холангіту. Холестаз і інфекційний процес викликають важкі зміни в печінці, що призводить до порушення її функції і може стати причиною смерті хворих в післяопераційному періоді. здавлення пухлиною v. portae призводить до розвитку портальної гіпертензії. Порушення надходження жовчі в кишечник викликає розлад травлення. Розвивається дисбактеріоз кишечника, знижується імунологічна захист організму, з'являється токсемия.
У 45-60% випадків жовтяниці супроводжує свербіж шкіри. Його інтенсивність не залежить від вираженості жовтяниці. Появі свербіння сприяє збільшення вмісту в крові гістаміноподібну речовин і жовчних кислот. У ряді випадків свербіж шкіри може з'явитися в дожелтушного періоді і бути першою ознакою холестазу.
виникнення втрати маси тіла пов'язане, з одного боку, з самим пухлинним процесом, що викликають зниження апетиту і підвищення основного обміну на 50-70%, а з іншого - зі здавленням пухлиною головного панкреатичного протоку, що призводить до порушення травлення, зумовленого недостатнім надходженням панкреатичних ферментів і жовчі в дванадцятипалу кишку.
При пухлинах головки ПЖ біль частіше локалізується в області епіга- стрия і в правому верхньому квадранті живота, при пухлинах тіла - по середньої лінії, а при раку хвоста ПЖ - в лівому верхньому квадранті. Біль може бути слабкою, наполегливої, тупий, різанням або ж сверлящей, иррадиирующей в спину. На відносно ранніх стадіях раку біль зустрічається у 30-40% хворих і пов'язана зі здавленням головного панкреатичного протоку, розвитком панкреатичної гіпертензії і панкреатиту. Сильна некупіру- емая біль свідчить про поширення пухлини на заочеревинного простору і інвазії в нервові сплетення.
диспептичні симптоми - анорексія, нудота, блювота, проноси, запори, метеоризм - спостерігаються приблизно у 40% хворих. Вони пов'язані з холестазом і секреторною недостатністю ПЖ.
слабкість, підвищена стомлюваність стають наслідком розладів харчування, анемизации, порушення обміну речовин.
Підвищення температури тіла спостерігається в 30% випадків. Найчастіше цей симптом виступає наслідком розвитку вторинного запального процесу - холангіту і панкреатиту. Рідше температура тіла підвищується через порушення терморегуляції при раку.
при об'єктивному дослідженні часто виявляють схуднення, жовтяницю, збільшення розмірів і болючість печінки. При обтураційній жовтяниці з'являється темна сеча (наявність жовчних пігментів) і знебарвлений гліноподобних кал. Незважаючи на збільшення жовчного міхура при холе- стазе, він пальпується тільки в 40-60% випадків (симптом Курвуазьє). Збільшений і безболісний жовчний міхур жовтяничного хворого, відсутність попередньої жовтяниці печінкової коліки змушує припустити пухлинну обтурацию позапечінкових жовчних проток.
спленомегалія може бути результатом портальної гіпертензії, що розвивається внаслідок здавлення, пухлинної інфільтрації або тромбозу ворітної і селезінкової вен (іодіеченочний портальний блок). При розпаді раку БДС, проростанні пухлини головки ПЖ в дванадцятипалу кишку можуть спостерігатися кровотечі. Пухлина, що розташовується в області тіла і хвоста залози, пальпується приблизно у 40-50% хворих, що служить поганим прогностичним ознакою, що свідчить про велику поширеність процесу. гепатомегалия, пов'язана з холестазом, частіше визначається при пухлинах головки, а бугристость поверхні печінки свідчить про наявність в ній метастазів. До физикальном ознаками раку ПЖ відноситься систолічний шум, який можна чути під мечовиднимвідростком або трохи лівіше. Він пояснюється інвазією пухлини і (або) здавленням нею чревного стовбура і (або) селезінкової артерії і тому, як правило, виявляється ознакою значного місцевого поширення пухлини.
Ракова пухлина сприяє підвищенню згортання крові, тому при РПЖ іноді виникають периферичні тромбофлебіти. Цьому сприяє і проникнення з паренхіми підшлункової залози в кров трипсину, підвищує активність згортання. Тромбофлебіти зустрічаються приблизно у 10% хворих, причому частіше при пухлинах тіла або хвоста ПЖ.
асцит при раку ПЗ виникає внаслідок метастазування пухлини по очеревині, здавлення ворітної вени, масивного метастатичного ураження печінки, прогресуючої гінопротеінеміі. При ацінарноклеточной карциноме, яка зустрічається рідко (в 1-3% випадків), під шкірою можуть з'являтися хворобливі вузлики, зумовлені вогнищевим некрозом підшкірної клітковини, а також болі в суглобах.
Описані симптоми, як уже вказувалося, досить пізні, і виконати радикальну операцію при їх наявності можна лише у 10-20% хворих. Однак в деяких випадках раптово розвинувся цукровий діабет або гострий панкреатит у хворих старше 50 років можуть бути першими проявами раку цієї локалізації. Іноді вони відзначаються за один - два роки до появи інших клінічних ознак. Розвиток цукрового діабету на ранніх стадіях пов'язують з виробленням пухлиною супрессора периферичних рецепторів інсуліну. Панкреатит буває першим проявом захворювання, якщо пухлина локалізується в головному панкреатичної протоці або близько від нього, рано викликаючи порушення відтоку соку ПЖ.
Таким чином, виходячи з викладеного вище, рак підшлункової залози слід підозрювати у хворого в віці старше 50 років, у якого визначається будь-який з наступних клінічних ознак (в порядку спадання значущості):
Лабораторна діагностика. Дані традиційних лабораторних досліджень найчастіше не специфічні для раку підшлункової залози.
анемія зустрічається у половини хворих РПЖ і пояснюється пригніченням кровотворення і (або) нерідко супутнім ерозивні дуоденітом, проростанням пухлини і кровотечею з неї в просвіт ДПК. лейкоцитоз відзначається тільки при розвитку холангіту і деструктивного панкреатиту. Рівень амілази і ліпази в сироватці крові підвищується в 10% випадків. Рак головки ПЖ з обструкцією жовчної протоки супроводжується гіпербілірубінемією (з переважанням прямої фракції). Холе- стаз призводить до глибоких порушень обміну ліпідів, внаслідок чого відзначається збільшення вмісту холестерину в сироватці крові. При пухлинної жовтяниці підвищення лужної фосфатази (ЛФ) в 5-10 разів наголошується в 90% випадків, причому приблизно в третині випадків це може статися і до появи гіпербілірубінемії. Зміст ЛФ підвищується як в результаті порушення природного шляху її виведення іекскреції гепатоцитами, так і внаслідок різкого збільшення синтезу проліферуючим епітелієм жовчних канальців. При тривалій механічній жовтяниці відзначаються диспротеїнемія і гипопротеинемия, зниження рівня протромбіну. Зміст аланінамінотрансферази (АЛТ) і аснартатамінотрансферази (ACT) у більшості хворих буває підвищеним не більше ніж в 5-10 разів, що використовується для диференціальної діагностики з вірусним гепатитом, при якому рівень цих ферментів підвищується в десятки разів. Зміни в крові, сечі і калі у хворих на рак тіла і хвоста Г1Ж часто відсутні. У 10-52% пацієнтів відзначається інсулінова недостатність, що проявляється тим або іншим ступенем гіперглікемії та пов'язане з одним з таких чинників:
При раку головки ПЖ калові маси мають характерний «жирний» блиск і м'яку консистенцію. стеаторея визначається при копрологі- зації дослідженні у 10-20% хворих, можуть спостерігатися також креа- Торі і алшлорея.
Запропоновано застосування в якості скринінг-тесту раку ПЖ визначення рівня пухлинних маркерів. Найбільший інтерес з них представляють кар- богідратние антигени СА 19-9, СА 50, СА 72-4, С А 125, С А 242, САМ 17-1, канцерембріоіальний антиген (СЕА); ферменти: GT-11, еластаза. Досить інформативний і добре вивчений пухлинний маркер СА 19-9. Вважається, що при раку підшлункової залози цей маркер діагностично значущий і з його допомогою можна більш точно визначити стадію раку, оцінити ефективність хірургічного та химиолучевого лікування, а ступінь зниження рівня С А 19-9 після резекції ПЖ але приводу раку служить прогностичним фактором, і в цих випадках маркер може бути використаний для динамічного спостереження за хворими. Діагностична чутливість СА 19-9 при раку ПЗ становить 73-95%, специфічність - 63-78%, ефективність - 76-97% 1.
Недоліком СА 19-9 виступає те, що його рівень буває нормальним на ранніх стадіях раку ПЖ, що ускладнює використання цього пухлинного маркера для скринінгу. Відомі випадки, коли і при поширеному раку ПЖ з множинними віддаленими метастазами рівень СА 19-9 істотно не підвищувався або навіть залишався в межах норми. Це пояснюють тим, що С А 19-9 і багато інших пухлинні маркери - білки ектодермального походження, що утворюються у людей, еритроцити яких містять Lewis-антиген.
Підвищення рівня СЕА при раку ПЗ найчастіше свідчить про метастатичному ураженні печінки. Пацієнти, у яких рівень СЕА більше 15 нг / мл, мають достовірно меншу виживаність. Практичні можливості використання СЕА при діагностиці раку ПЖ обмежені, так як його чутливість становить 35-62%, специфічність - 52-77%, а ефективність - 64-75%. З огляду на все сказане, СЕА застосовується для підвищення ефективності діагностики раку ПЖ в комплексі з іншими пухлинними маркерами.
Недостатня специфічність пухлинних маркерів, особливо при невеликих, видалимих пухлинах, підвищення їх рівня при непухлинних захворюваннях
1 Діагностична чутливість методу є відсоток їх частоти істинно позитивних результатів тесту (дослідження) у хворих з даною хворобою (рак ПЖ зокрема). Діагностична специфічність - відсоток їх частоти істинно негативних результатів у осіб, нс які страждають на хворобу (рак ПЖ в даному випадку). Діагностична ефективність тесту, або точність інструментального дослідження, виражається процентним відношенням справжніх, т. Е. Відповідають станом обстежуваних пацієнтів, результатів тесту до загальної кількості отриманих результатів.
печінки і підшлункової залози, колоректальному і деяких інших раках обмежує діагностичне значення С А 19-9, РЄ А і інших маркерів при раку підшлункової залози.
Інструментальна та апаратна діагностика. Завданням передопераційної діагностики виступає не тільки встановлення діагнозу раку ПЖ, а й визначення стадії захворювання, так як від цього буде залежати лікувальна тактика.
Необхідно розрізняти неінвазивні (УЗД, КТ, релаксационная дуоде- іографія, магнітно-резонансна томографія (МРТ), магнітно-резонансна холангіопанкреатографія (МРХПГ), позитронна емісійна томографія, ендоультрасонографія, фіброгастродуоденоскопія) і інвазивні методи діагностики раку ПЖ і періампулярной області (лапароскопія, ретроградна холангиопанкреатография, черезшкірна чреснеченочная холангиография, тонкоигольная аспіраційна біопсія під контролем УЗД або КТ, ангіографія). Дослідження проводяться за принципом «від простого до складного», причому не слід застосовувати інвазивні методи, якщо діагноз можна поставити, виконавши доступні неінвазивні і малоінвазивні дослідження.
Певний прогрес в діагностиці раку ПЖ, досягнутий за останні роки, пов'язаний з появою в повсякденній практиці нових інструментальних методів досліджень, що дозволяють не тільки встановити діагноз, але і в багатьох випадках визначити стадію захворювання.
Першим етапом діагностичної програми, спрямованої на виявлення пухлини ПЖ і визначення її поширеності, виступає ультразвукове дослідження. Характерними ознаками раку ПЖ за даними УЗД служать локальне збільшення розмірів органу, наявність оіухолеіо- добіого гіпоехогенний освіти, горбисті контури ПЖ в області пухлини (рис. 21.1).
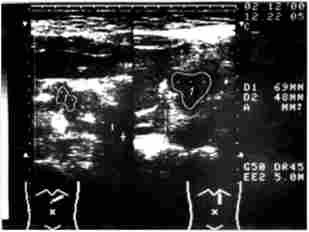
Мал. 21.1. Ультразвукове дослідження.
Рак головки підшлункової залози:
1 - гіпоехогеіная горбиста ракова пухлина 5 х 4 см
Важливим моментом в ультразвукової діагностики раку головки ПЖ вважається візуалізація головного панкреатичного протоку (ДПП) і визначення його діаметра. Навіть невеликі пухлини, які не видно при УЗД, можуть привести до порушення прохідності ДПП і вторинному його розширення, що служить непрямою ознакою наявності пухлини. Розширення ДПП виявляють у 85-92% хворих на рак головки ПЖ. Діагностична точність методу складає 67-86% і істотно залежить від досвіду і кваліфікації лікаря, що виконує УЗД.
Збільшені регіонарні лімфатичні вузли при УЗД можна виявити в 30-47% випадків, метастази в печінці - в 46-74%, тому його чутливість в оцінці резектабельності не перевищує 40%.
Недостатня ефективність ультразвукової діагностики раку ПЖ пояснюється і обмеженими до 1-2 см разрешающими здібностями ультразвукових апаратів. На підставі даних УЗД в більшості випадків складно судити про інвазії пухлини в прилеглі структури, диференціювати невеликі (до 3 см) ракові пухлини від запальних уражень ПЖ.
Суттєве значення в діагностиці пухлин ПЖ має Комп'ютерна томографія. Основні ознаки, що дозволяють запідозрити рак ПЖ при комп'ютерної томографії: збільшення розмірів залози на локальній ділянці, горбисті контури ПЖ в цій області, наявність пухлиноподібних гіподенсного вузла, пухлинна інвазія періпанкреатічної клітковини. Розширення ДПП при КТ діагностується набагато рідше, ніж при УЗД, що пов'язано з великою товщиною зрізів при КТ (5-8 мм). Діагностична точність КТ становить 72-91%. Роздільна здатність КТ в основному близька до такого при УЗД, хоча метод має дещо більшою інформативністю у встановленні поширення раку ПЖ на навколишні органи і структури, в виявленні регіонарних метастазів (рис. 21.2 і 21.3).
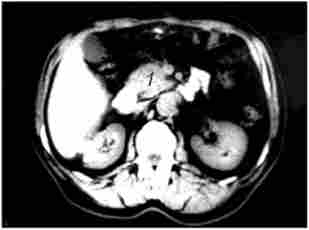
Мал. 21.2. Комп'ютерна томографія. Рак головки підшлункової залози:
1 - гіподенсная горбиста пухлина головки підшлункової залози 4 х 5 см
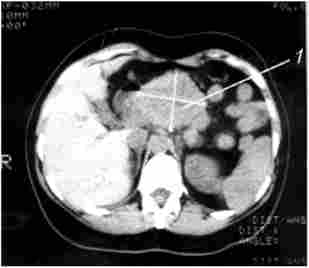
Мал. 213. Комп'ютерна томографія. Рак тіла підшлункової залози:
1 - гіподенсная пухлина тіла підшлункової залози з нерівними горбистими контурами 6x6 см
Диференціальна діагностика раку, інших пухлин ПЖ і псев- дотуморозного хронічного панкреатиту (ХП) за даними КТ і УЗД досить складна і часто неможлива. Наявність кіст в області пухлинного освіти, панкреатична гіпертензія зустрічаються в обох випадках і не служать надійними диференційно-діагностичними ознаками. Кальцинати в проекції пухлини при раку ПЗ зустрічаються нечасто. У 95% спостережень кальциноз свідчить про хронічному панкреатиті.
Отже, для виявлення пухлин підшлункової залози КТ краще, ніж УЗД, так як дає більше інформації про поширення пухлини па суміжні анатомічні структури і її результати не настільки залежні від досвіду лікаря, що виконує дослідження. УЗД і КТ - взаємодоповнюючі дослідження, і їх слід застосовувати разом. У комбінації це дозволяє підвищити точність діагностики ракового ураження ПЖ до 90%.
Нещодавно з'явилася нова концепція сканування, названа спіральної комп'ютерної томографії (СКТ), значно збільшила можливості діагностики захворювань ПЖ. В процесі цього дослідження відбувається спиралеобразное рух веерообразного променя через тіло пацієнта. Велика анатомічна область може бути просканувати за один період затримки дихання пацієнтом, причому виходять тонкі дотичні «зрізи» товщиною до 3 мм. СКТ забезпечує створення високоякісних тривимірних реконструкцій. При цьому дослідженні можна виявити освіти розмірами від 4 мм.
Локальна інвазія прилеглих вісцеральних судин ускладнює і нерідко робить неможливим виконання резекції у великого числа хворих на рак ПЖ, тому дООНераціонной діагностиці пухлинного проростання судин, особливо ворітної вени, надається велике значення (рис. 21.4). У комбінації з внутрішньовенним болюсним контрастуванням і субтракційної обробкою даних можна реконструювати СКТ-ангіограми, які відтворюють проекційні тривимірні зображення пухлини і судинного русла, визначити резектабель- ність пухлини з точністю 56-78%. Вважається, що результати СКТ можна порівняти з такими при спільному застосуванні КТ і ангіографії.
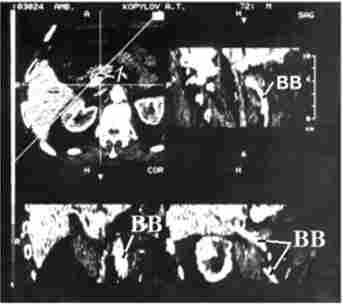
Мал. 21.4. Спіральна комп'ютерна томографія з портографіей.
Рак головки підшлункової залози:
1 - гіподенсная горбиста пухлина головки підшлункової залози 4x5 см;
В В - контрастував паю воротная вена, яку проростає пухлина
Магнітно-резонансна томографія, за даними більшості дослідників, не має істотних переваг перед УЗД і КТ в діагностиці захворювань підшлункової залози. Крім того, МРТ відрізняється більш високою вартістю.
В останні роки з'явився новий неінвазивний метод - магнітно резонансна холангіопанкреатографія (Рис. 21.5), який дозволяє візуалізувати жовчні і панкреатичні протоки без інвазивних втручань і введення контрастних речовин. Це дослідження можна здійснити майже у всіх хворих, не дає ускладнень і дозволяє отримати таку ж інформацію, як і при одночасному застосуванні КТ, ангіографії та ретроградної холангіопанкреатографія (РХПГ).
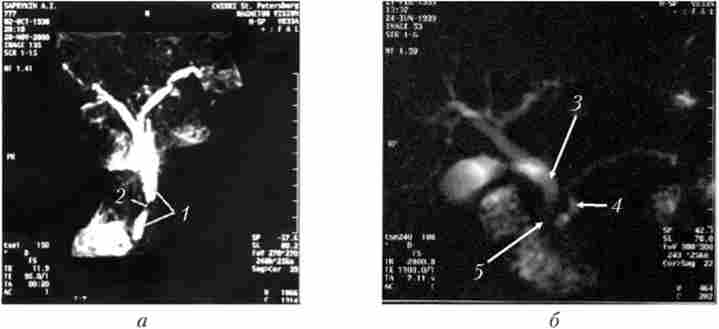
Мал. 21.5. Магнітно-резонансна холангіопанкреатографія.
Рак головки підшлункової залози:
а - пухлина діаметром 1,5 см (було виявлено тільки інтраонераціонно);
б - пухлина діаметром 3 см (було виявлено при ультразвуковому дослідженні, комп'ютерної томографії та інтраонераціонно);
Досить достовірні дані про місцеве поширення пухлини, інвазії судин, регіонарних метастазах можуть бути отримані при використанні ендоультрасонографіі (ЕУСГ) - нового методу діагностики, ефективність якого широко обговорюється в літературі. При цьому дослідженні датчик можна підвести безпосередньо до пухлини (лапароскопично, через шлунок і ДНК, інтрадуктально через БДС, інтрапортально), що дозволяє виявити освіти менше 1 см, а при інтрадуктальном УЗД - пухлини до 2 мм, збільшені лімфатичні вузли, інвазію великих судин, виконати голкові біопсію цих утворень. Недоліком ЕУСГ виступає велика залежність результатів досліджень від досвіду лікаря, що виконує дослідження, що істотно обмежує його застосування і заважає широкому поширенню методу (рис. 21.6).
Останнім часом значну роль у вирішенні питань діагностики та визначенні стадії раку ПЖ грає позитронна емісійна томографія (ПЕТ). Вона дозволяє здійснювати кількісну оцінку концентрації радіонуклідів в пухлини і уражених нею лімфатичних вузлах на різних стадіях захворювання (рис. 21.7). З цією метою при дослідженні застосовуються радиофармацевтичні препарати, мічені циклотрон радіонуклідами. Можливості ПЕТ при виявленні пухлин менше 2 см, метастазів печінки, метастатичних лімфатичних вузлів перевищують такі при комп'ютерної томографії. Більшість дослідників застосовують ПЕТ при диференціальної діагностики злоякісних і доброякісних утворень ПЖ. У літературі є відомості і про можливість визначення при цьому методі ступеня злоякісності пухлини в залежності від інтенсивності накопичення препарату. Однак для оцінки резектабелиюсті ПЕТ не може замінити КТ.
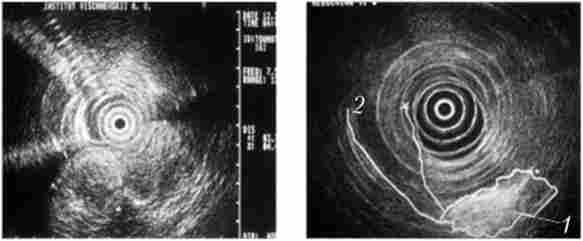
Мал. 21.6. Ендоультрасонографія:
1 - пухлина головки підшлункової залози; 2 - розширений термінальний відділ загальної жовчної протоки
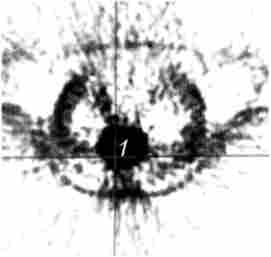
Мал. 21.7. Позитронна емісійна томографія тієї ж хворий,
що і на рис. 21.2:
1 - вогнище підвищеного накопичення 18F-ФДГ діаметром 6 см з коефіцієнтом диференціального накопичення пухлина / нормальна тканина (КНД)
Крім того, ПЕТ не дозволяє поставити топічний діагноз, тому його слід застосовувати в поєднанні з комп'ютерною томографією. Основний недолік дослідження - необхідність використання доростоя- щей апаратури для виробництва радіонуклідів, які мають короткий період напіврозпаду (від декількох хвилин до двох годин), що вимагає близького розташування циклотрона до лабораторії.
На жаль, більшість з перерахованих методів дослідження (крім ПЕТ) не дозволяють з абсолютною точністю диференціювати рак підшлункової залози і нсевдотумморозний панкреатит. При них виявляється лише об'ємне утворення і (або) непрямі ознаки його наявності, а яка природа «пухлини» - невідомо. Тільки при ПЕТ можна встановити злоякісний характер пухлини з точністю 60-90% (такий розкид цифр пояснюється поки ще недостатнім досвідом застосування цього дослідження).
Крім того, жоден з існуючих методів дослідження не дозволяє точно встановити поширення ракової пухлини ПЖ на навколишні органи і структури (в першу чергу судини), що важливо при передопераційної оцінки стадії захворювання для визначення лікувальної тактики (операція, променева терапія, хіміотерапія або їх поєднання ).
Ендоскопічні дослідження. при фиброгастродуоденоскопии діагноз грунтується на візуальному виявленні пухлини, проростає стінку полого органу, або на виявленні її непрямих ознак (деформація і здавлення задньої стінки пілороантралиюго відділу шлунка, задневнутренней стінки цибулини і внутрішньої стінки вертикальної частини ДПК, нерівність деформованої поверхні стінки і щільність вдавленого ділянки).
лапароскопія у багатьох випадках дозволяє до операції орієнтовно встановити локалізацію пухлини, межі її поширення. Однак, для того щоб побачити ПЖ, необхідне застосування спеціальних маніпуляторів і прийомів (огляд ПЖ виробляють через малий сальник, «вікно» в шлунково-поперечноободочной зв'язці). Лапароскопічна картина при пухлинної жовтяниці характерна: печінку, як правило, збільшена, застійні, з зеленуватим відтінком, на її поверхні можна виявити метастатичні вузли. Жовчний міхур при блокаді дистального відділу жовчної протоки різко напружений, збільшений в розмірі. При лапароскопії можна виконати пункцію жовчного міхура, холецістохолангіографію, холецістостомію з метою декомпресії та усунення жовтяниці, накласти микрогастростому для реінфузії жовчі, що відтікає через холецістосто- мічеський дренаж в післяопераційному періоді.
рентгенологічні дослідження. Рентгенологічне контрастне дослідження дванадцятипалої кишки дозволяє виявити патологічний процес, що розташовується не тільки в самій кишці, але і в органах, безпосередньо прилеглих до неї. Застосування релаксационной дуоде- монографій дозволяє, як правило, виявити пухлину БДС і, в деяких випадках, за непрямими ознаками - головки підшлункової залози, а також судити про стан стінок самої дванадцятипалої кишки (рис. 21.8 і 21.9). Деформація контурів, звуження просвіту ДПК, розгорнення її петлі служать непрямими ознаками, що дозволяє висловити припущення про наявність патологічних змін в ПЖ тільки в тому випадку, якщо пухлина досягне значної величини. При РПЖ відхилення від норми виявляють лише у 50% хворих.
Для з'ясування причини механічної жовтяниці і визначення рівня обтурації жовчних проток використовуються методи їх прямого контрастування '. чрескожная чреснеченочная холангиография, черезшкірна холецістохолангіографія йод контролем лапароскопа або УЗД. Завдяки високій якості одержуваного рентгенівського зображення пряма холангиография відповідає всім вимогам сучасної діагностики, дозволяючи ще до операції виявити і уточнити локалізацію обтурирующем пухлини і стан жовчних проток. При дистальної обтурації загальної жовчної протоки відзначається розширення всієї біліарної системи. Контрастне речовина не надходить в дванадцятипалу кишку, конфігурація дистального відділу жовчної протоки має вигляд конічного звуження з нерівними зубчастими або фестончастими контурами, нагадуючи кінець сигари або письмової пера (рис. 21.10).
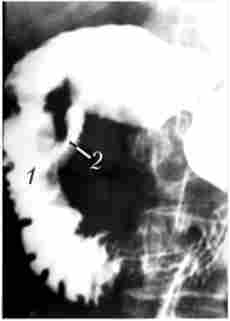
Мал. 21.8. Дуоденографія в умовах гіпотонії:
1 - ділянку відсутності рельєфу слизової оболонки протягом 2 см по медіального контуру дванадцятипалої кишки у верхній половині спадної частини кишки; 2 - порожнину розпалася пухлини за межами кишки,
в яку затікає контраст
Мал. 21.9. Макропрепарат після панкреатодуоденальной резекції, виконаної тієї ж хворий, знімок якої показаний на рис. 21.8:
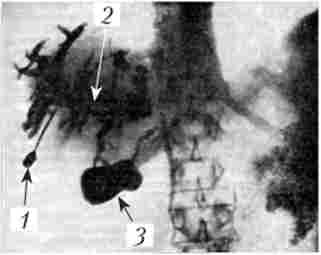
Мал. 21.10. Черезшкірна гепатохолангіограмма.
Рак головки підшлункової залози:
При раку головки ПЖ, перехідному на панкреатичну частина жовчної протоки, рентгенологічна тінь останнього обривається в дистальному відділі у вигляді нерівній горизонтальній, напівкруглої або конічної лінії. Якщо пухлина головки ПЖ поширюється на вище розташовані відділи жовчної протоки, то тінь контрастувало жовчної протоки стає коротшим, а при залученні в процес пузирногопротоки жовчний міхур не контрастіруете ^.
Інший метод прямого контрастування жовчних і панкреатичних проток - їх ретроградний заповнення контрастною розчином при ендоскопічної катетеризації фатерову ампули (ендоскопічна ретроградна холангіопанкреатографія - ХПГ). Цей метод був широко впроваджений в клінічну практику в 1980-і рр. Діагностична точність ЕРХПГ при раку ПЗ становить 70-80%.
Діагноз грунтується на змінах, які виявляються на панкреато- грамах (стеноз або обструкція протоки ПЗ), характер яких залежить від розмірів пухлини, її локалізації та взаємовідносини з протоковой системою органу. Пухлина, що виходить з епітелію головного панкреатичного протоку або розташовується в безпосередній близькості від нього, навіть при невеликих розмірах швидко призводить до змін у всій системі проток. При локалізації раку на деякій відстані від головного панкреатичного протоку зміни в першу чергу виникають в дрібних протоках, тоді як в головному протоці їх немає (рис. 21.11).
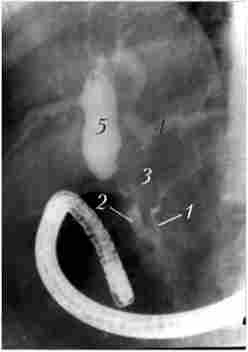
Мал. 21.11. Ендоскопічна ретроградна холангіопанкреатографія. Рак головки підшлункової залози, механічна жовтяниця:
Для виявлення зв'язку пухлини з судинами і уточнення ангіоархітек- топіки застосовується ангіографія. При раку підшлункової залози виникають зміни в її судинах або судинах, розташованих в безпосередній близькості: змінюється просвіт і положення судин, порушується кровообіг, з'являються атипові судини. Існує кілька методик контрастування артерій і вен ПЖ:
Для пухлини характерні зміщення, деформація, оклюзія судин (рис. 21.12). Діагностична точність методу складає близько 70%.
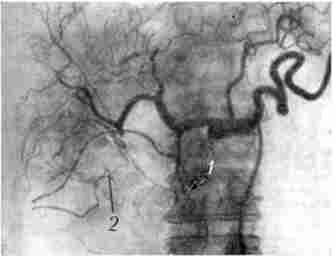
Мал. 21.12. Целіакограмма. Рак головки підшлункової залози,
артеріальна фаза:
Біопсія. Верифікації діагнозу при об'ємних утвореннях ПЖ надається велике значення, так як від цього залежить вибір методу лікування. З цієї точки зору для уточнення діагнозу або вибору лікувальної тактики показана тонкоигольная аспіраційна біопсія (ТІАБ) ПЖ під контролем УЗД або КТ (рис. 21.13). Метод доступний, відносно безпечний для хворого і досить надійний.
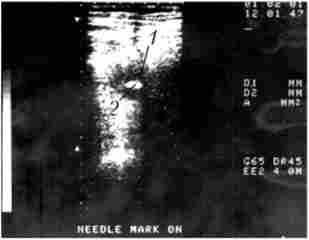
Мал. 21.13. Тонкоголкова аспіраційна біопсія під контролем УЗД. Рак тіла підшлункової залози:
Доопераційна ТІАБ виконується при диференціальної діагностики раку підшлункової залози і хронічного панкреатиту, верифікації раку ПЖ з метою проведення хіміопроменевої терапії до операції або без неї. При цьому діагностична точність ТІАБ становить 67-96%.
Однак голкові біопсію не рекомендують застосовувати пацієнтам, яким належить операція, особливо радикальна, так як навіть після повторних досліджень і отримання негативних результатів, особливо при пухлинах менше 2 см, не можна виключити злоякісну пухлину і в маленькі пухлини складно потрапити голкою. Крім того, є небезпека имплантационного метастазування по ходу пункційного каналу і пухлинного обсіменіння черевної порожнини. Винятком виступає ТІАБ при плануванні передопераційної хіміопроменевої терапії.
Є відомості про застосування ТІАБ під контролем ЕУСГ. При цьому можлива біопсія невеликих (менше 2 см) пухлин ПЖ і збільшених регіонарних лімфатичних вузлів. Діагностична точність методу при біопсії пухлини становить 92-97%, лімфатичних вузлів - 85-91%. Через складність це дослідження ще не набуло широкого поширення.
Для діагностики і верифікації раку ПЖ в даний час крім ТІАБ застосовують інтрабіліарную біопсію через черезшкірний жовчний дренаж, ендоскопічну браш-біопсію, цитологічне дослідження жовчі і панкреатичного соку, отриманих ендоскопічно. Діагностична точність таких досліджень досягає 90%, а специфічність - 100%.
Як уже згадувалося, жоден з наявних в даний час методів діагностики раку ПЖ не дає абсолютно достовірних результатів. Для отримання максимальної інформації слід проводити комплексне застосування декількох досліджень, що є в розпорядженні клініцистів. Доведено, що якщо передопераційне визначення стадії раку головки 11ж за допомогою КТ, ангіографії та лапароскопії не виявляється ознак нерезектабельних, то резектабельность наближається до 80%. Діагностичний алгоритм раку ПЖ відрізняється в кожному конкретному випадку і нерідко залежить від можливостей установи. Але навіть при використанні сучасних методів діагностувати рак ПЖ і визначити його стадію до операції нерідко буває досить складно, і справжнє поширення пухлини вдається встановити лише при лапаротомії.
Діагностичний алгоритм. При підозрі на РПЖ хворого спочатку обстежують за допомогою УЗД, КТ, виконують ФГДС, досліджують рівень пухлинних маркерів СА 19-9 і СЕА. При виявленні патології і ознак жовчної гіпертензії для уточнення діагнозу застосовують методи прямого контрастування жовчних шляхів і панкреатичних проток (або МРХПГ), а при підозрі на залучення в пухлинний процес судин слід поставити питання про проведення селективної ангіографії (портографіі) або СКТ-портографіі. Для верифікації пухлини виконують ТІАБ під контролем УЗД або КТ, а також субопераційне біопсію.
Діагностична лапаротомія виступає заключним етапом діагностики, а в більшості випадків і лікування раку ПЖ. Майже у половини хворих, у яких на підставі даних доопераційний досліджень пухлина визнається РЕЗЕКТАБЕЛЬНОМ, під час ревізії органів черевної порожнини і ПЖ виявляють віддалені метастази або місцеве поширення пухлини (в основному на ворітну або верхню брижових вену). При діагностичної лапаротомії, особливо при непідтвердженому діагнозі раку ПЖ, слід виконувати інтраопераційну ТІАБ пухлини ПЖ з терміновим цитологічним дослідженням отриманого матеріалу. Діагностична точність методу складає 80-90% і залежить від розмірів пухлини. Труднощі виникають при інтраопераційної діагностики, коли є невелика (до 3 см) пухлина в товщі залози. Тільки в половині випадків це виявляється хронічний панкреатит, в інших - РПЖ. Тому ми виступаємо прихильниками виконання резекції ПЖ при неможливості виключити рак. Зрозуміло, така тактика допустима лише в установах, що мають великий досвід операцій на ПЖ і досягли певних успіхів у зниженні післяопераційної летальності.
Диференціальна діагностика раку підшлункової залози і хронічного псевдотуморозного панкреатиту. Найбільш складною і не вирішеною до теперішнього часу є проблема диференціального діагнозу РПЖ і хронічного панкреатиту (XII), особливо при локалізації патологічного процесу в головці залози. Певне значення мають вік і стать хворих. Пік захворюваності на рак ПЖ доводиться на вік 60-70 років, а хронічним панкреатитом хворіють люди більш молодого віку, зазвичай 35-45 років. Переважна більшість хворих ХП (більше 80%) - чоловіки. Зловживання алкоголем протягом 10-15 років до початку захворювання також більш характерно для пацієнтів з хронічним панкреатитом.
Майже у всіх хворих на рак ПЖ (більше 90%) захворювання починається поступово, як правило, без будь-яких провокуючих чинників. Разом з тим при хронічному панкреатиті більшість пацієнтів відзначають гострий початок захворювання і зв'язок його з алкогольними або харчовими ексцесами. Тривалість клінічних проявів при раку ПЗ становить два-три місяці, а при хронічному панкреатиті - більше року.
Провідними симптомами раку ПЖ і хронічного панкреатиту служать біль і втрата маси тіла, а для раку головки ПЖ також характерна жовтяниця.
На підставі даних УЗД і КТ провести диференціальну діагностику раку ПЖ і хронічного панкреатиту складно навіть в спеціалізованій установі.
Рівень СА 19-9 при раку ПЗ, як правило, перевищує 100 од / мл, тоді як при хронічному панкреатиті такий рівень спостерігається вкрай рідко, що також може бути використано при проведенні диференціальної діагностики цих захворювань.
Тонкоголкова аспіраційна біопсія дозволяє виявити пухлинні клітини лише у 80% хворих на рак ПЖ, тому робити висновки, що виключають рак, на підставі даних ТІАБ не можна.
Перераховані клінічні, лабораторні та інструментальні ознаки хоча і можуть надати істотну допомогу в диференціальної діагностики раку ПЖ і хронічного панкреатиту, але остаточний висновок нерідко можливо лише під час операції і після планового гістологічного вивчення віддаленого органокомплекса.
Інформація, отримана при діагностиці раку ПЖ і дооперационном визначенні його стадії, служить основою планування лікування для кожного конкретного пацієнта. В результаті обстеження хворих на рак ПЖ виділяють наступні підгрупи:
Лікування. Операція - основний метод лікування раку підшлункової залози. Однак радикальне втручання часто неможливо через наявність віддалених метастазів, проростання магістральних судин, тяжкості стану хворого (механічна жовтяниця, печінкова недостатність). Рятувальна операція (навіть паліативної) на висоті жовтяниці супроводжується високою післяопераційною летальністю (до 40%).
Поліпшенню результатів операції, зниження ризику розвитку післяопераційних ускладнень, зняття синдрому холемии і жовчної гіпертензії сприяє попередня декомпресія жовчних шляхів: Лапароскопічна холецістостомія, черезшкірна чреспеченочная холецістостомія, черезшкірна чреспеченочная холангіостомія, ендобіліарное зовнішньо-внутрішнє дренування, ендоскопічне транспапіллярное назобіліарное дренування жовчної протоки, ендоскопічна напіл- лосфінктеротомія через пухлину БДС. Декомпресія жовчних шляхів, як правило, сприяє швидкій регресії симптомів холестазу, яка супроводжується позитивною динамікою клініко-лабораторних показників. Другим етапом виконують радикальну операцію, а при неоперабельности - той чи інший вид паліативного втручання.
паліативні операції складають до 80% всіх втручань, які виконують при раку ПЗ, так як пухлина рано метастазує і поширюється на прилеглі органи. Вони переслідують наступні цілі:
Для усунення механічної жовтяниці застосовуються різні види біліодігестівниханастомозів або зовнішнє дренування жовчних шляхів з реінфузія жовчі.
Сполучення жовчного міхура з тонкою кишкою (операція Монастирського) виконується при прохідному протоки міхура. Операція технічно нескладна і малотравматичні, але істотний її недолік - небезпека розвитку рецидиву жовтяниці при проростанні пухлиною протоки (рис. 21.14).
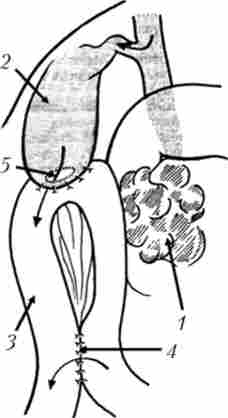
Мал. 21.14. Холецістоеюноанастомоз з міжкишкових анастомозу але Брауну:
Гепатікоентероанастомоз проводиться в випадках, коли пухлинний інфільтрат поширюється але жовчному протоку в напрямку воріт-печінки, захоплюючи міхуровопротока і залишаючи вільним загальну печінкову протоку або тільки часткові протоки печінки (рис. 21.15). При поширенні пухлини в ворота печінки іноді накладають анастомози звнутрішньопечінковий жовчними протоками.
З метою усунення або попередження виникнення явищ непрохідності ДПК виробляють формування гастроентероанастомоза, частіше - впередіободочного з міжкишкові соустя (рис. 21.16).
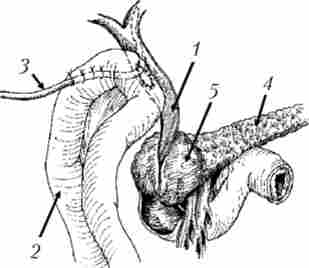
Мал. 21.15. Схема операції накладення обхідного гепатікоеюноанастомоз при раку головки підшлункової залози, ускладненому механічною жовтяницею. Анастомоз сформований на дренажі, виведеному через анастомозірованной кишку:
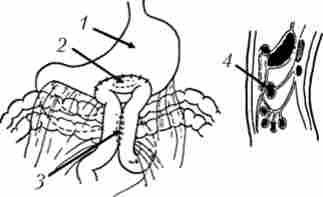
Мал. 21.16. Передній впередіободочний гастроентероанастомоз з міжкишкові соустя по Брауну:
Для зменшення больового синдрому застосовують інтраопераційну алкоголізацію чревного сплетення (40 мл 50 ° -го спирту). Зовнішнє дренування блокованого головного панкреатичного протоку сприяє купірування вторинного панкреатиту і зменшення болю.
В останнє десятиліття, у зв'язку з розвитком ендовідеохірургія, для зменшення больового синдрому і підвищення якості життя хворих нерезектабельних раком Г1Ж виконують торакоскопічних спланхнік- ектомія. Відомо, що чутливі нервові волокна, які проводять больові імпульси від підшлункової залози, входять в сонячне сплетіння, далі йдуть в складі внутренностних нервів і через симпатичні ганглії слідують в провідні шляхи спинного мозку. Патогенетичним обґрунтуванням торакоскопічної спланхнікектоміі виступає переривання патологічних больових імпульсів від підшлункової залози шляхом висічення ділянок чревного нервів. Більшість авторів виконують операцію з лівого боку на рівні ThX - 77 / XI, і якщо аналгетичний ефект недостатній, операцію через кілька днів виконують справа (рис. 21.17). У більшості пацієнтів вдасться отримати терапевтичний ефект - болі зменшуються в середньому в 2 рази, що сприяє підвищенню якості життя хворих з нерезектабельних раком ІЖ.
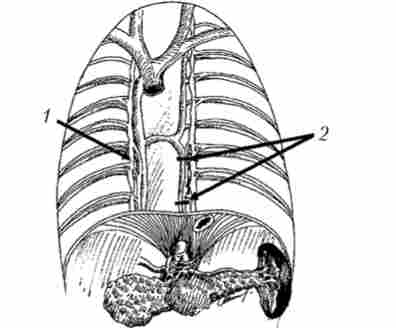
Мал. 21.17. Схема торакоскопічної лівосторонньої спланхнікектоміі з видаленням великого чревного нерва на рівні ThX - тихийI:
1 - чревного сплетіння; 2 - протяжність висічення великого чревного нерва
радикальні операції можливі лише у 6-30% хворих на рак ПЖ. Ці операції технічно важкі, що пояснюється складними тонографо- анатомічними взаємовідносинами ПЖ з прилеглими органами і великими судинами, особливо з ворітної веною.
Радикальною операцією при раку головки ПЖ вважається панкреатодуоденальная резекція (стандартна ПДР, операція Уиппла) - втручання, при якому видаляється головка ПЖ разом з дванадцятипалої кишкою, дистальним відділом загальної жовчної протоки, дистальної частиною шлунка (рис. 21.18). Етапи ПДР представлені на рис. 21.19-21.23.
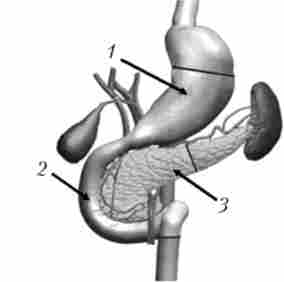
Мал. 21.18. Класична панкреатодуоденальная резекція - операція Уиппла:
1 - шлунок; 2 - дванадцятипала кишка; 3 - підшлункова залоза
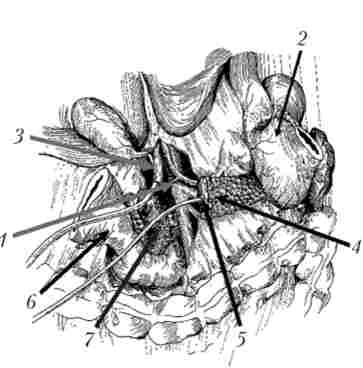
Мал. 21.19. Видалення панкреатодуоденальную комплексу. Органокомплекси фіксований на прошитою сшивающим апаратом У О (праворуч від верхньої брижової вени) дванадцятипалій кишці і крючковидного відростку:
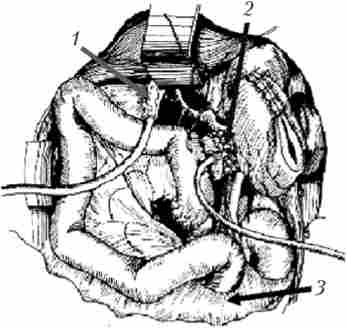
Мал. 21.20. Реконструктивний етап ПДР.
У-образно відключена петля тонкої кишки, яка проведена позаду ободової кишки і розташована таким чином, щоб не було перекругов і натягу. Кишка П-образними швами підшита до культі ПЖ, в ній намічено отвір, що збігається з головним панкреатичним протокою при підведенні кишки до ПЖ: 1 - загальний жовчний протік; 2 - кукса підшлункової залози;
3 - брижа поперечної ободової кишки
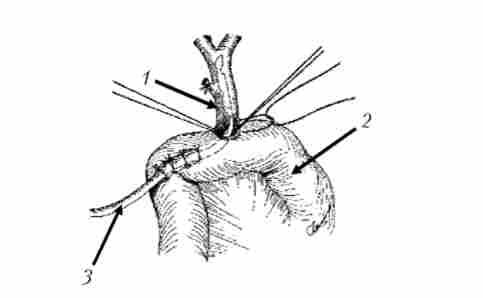
Мал. 21.21. Реконструктивний етап ПДР. Формування холедохоеюноанастомоза:
1 - загальний жовчний протік; 2 - тонка кишка; 3 - дренаж
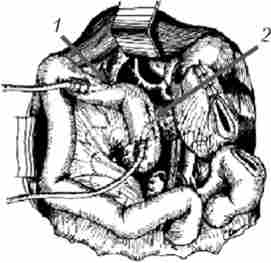
Мал. 21.23. Панкреато- і холедохоеюноанастомоз сформовані на дренажах:
1 - холедохоеюноанастомоз; 2 - панкреатоеюноанастомоза
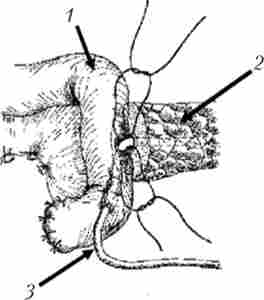
Мал. 21.22. Продовження етапу формування панкреатоеюноанастомоза. Нитками прошиті задня стінка головного панкреатичного протоку і кишка через всі шари. Дренажна трубка проведена через просвіт кишки і виведена назовні:
1 - тонка кишка, 2 - підшлункова залоза; 3 - дренаж
Варіанти завершення ПДР (реконструктивний етап ПДР) представлені на рис. 21.24-21.26.
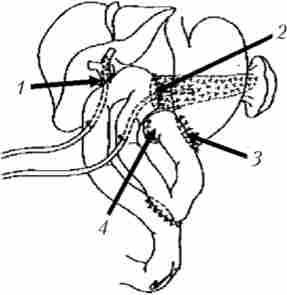
Мал. 21.24. Варіант завершення панкреатодуоденальной резекції. Сформовано панкреатоеюноанастомоза і холедохо- / гепатікоеюноанастомоз на відключеною міжкишкові соустя петлі тонкої кишки. Накладено гастроентероанастомоз, при цьому кукса дванадцятипалої кишки розташована забрюшинно:

Мал. 21.25. Варіант завершення панкреатодуоденальной резекції. Сформовано панкреатоеюноанастомоза і холедоха-Депатіко- еюноанастомоз на відключеною У-образної петлі тонкої кишки. Накладено гастроентероанастомоз, при цьому кукса ДПК розташована забрюшинно:
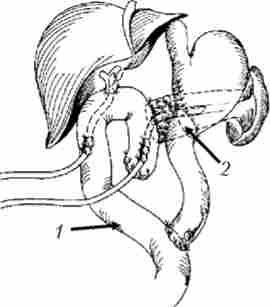
Мал. 21.26. Варіант завершення панкреатодуоденальной резекції з тотальною дуоденектоміей і накладеними панкреато- і гепатікоеюноанастомоз на У-образно відключеною петлі тонкої кишки.
Г астроентероанастомоз сформований за типом «кінець в кінець»:
Така операція при невеликих (до 2 см) пухлинах головки підшлункової залози може виконуватися і без резекції желз'дка (зі збереженням воротаря) (рис. 21.27 та 21.28).
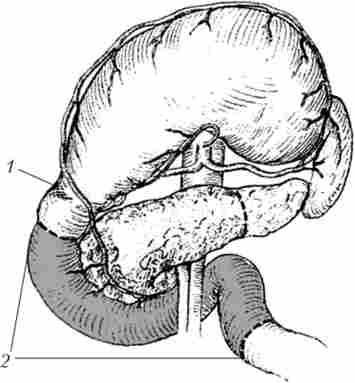
Мал. 21.27. Пілоруссохраняющая панкреатодуоденальная резекція. Межі мобілізації та резекції:
1 - воротар; 2 - кордони резекції
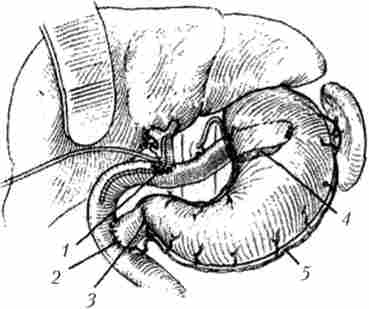
Мал. 21.28. Реконструктивний етап пілоруссохраняющей панкреатодуоденальной резекції:
Існує ще одна методика ПДР: зі збереженням і воротаря, і жовчного міхура, хоча, на нашу думку, збереження жовчного міхура при панкреатодуоденальной резекції навряд чи доцільно (рис. 21.29 та 21.30).
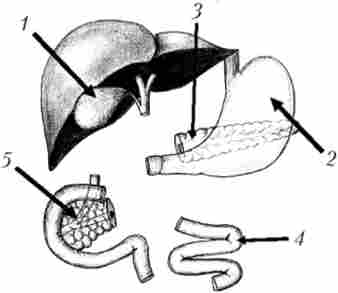
Мал. 21.29. Схема резекційну етапу панкреатодуоденальной резекції зі збереженням воротаря і жовчного міхура:

Мал. 21.30. Схема реконструктивного етапу панкреатодуоденальной резекції зі збереженням воротаря і жовчного міхура:
1 - жовчний міхур, 2 - шлунок, 3 - підшлункова залоза, 4 - тонка кишка
Відновлювальний етап операції включає наступні елементи:
При ускладненні раку ПЖ панкреатитом або гнійним холангітом
не завжди доцільно закінчувати ПДР формуванням жовчного і (або) панкреатичного анастомозів з худою кишкою. Зазвичай протоки спочатку дренируют назовні і лише на другому етапі втручання накладають біліодігестівних і панкреатодігестівний анастомози. За останнє десятиліття вдалося знизити госпітальну летальність при панкреатодуоденальной резекції до 3-5%, однак п'ятирічне виживання становить лише 5-10%. Віддалені результати радикальних операцій при раку БД С, термінального відділу холедоха і ДПК значно краще - п'ятирічне виживання становить 20-50%.
При раку головки і тіла ПЖ виконується тотальна дуоденопанкреат- ектомія (рис. 21.31), при раку тіла і хвоста ПЖ - дистальна резекція підшлункової залози (рис. 21.32, 21.33). Ці операції застосовуються рідко, оскільки рак таких локалізацій, як правило, діагностується занадто пізно.
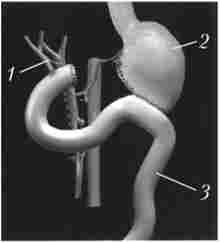
Мал. 21.31. Тотальна дуоденопанкреатектомія:
1 - загальний жовчний протік, 2 - кукса шлунка, 3 - тонка кишка
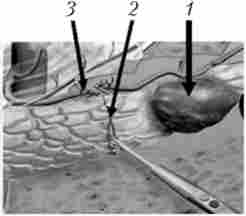
Мал. 21.32. Дистальна резекція підшлункової залози - перев'язка селезінкових судин і перетин тканини підшлункової залози:
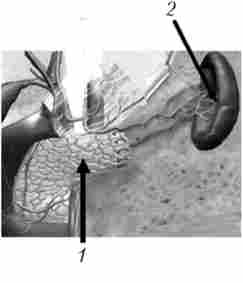
Мал. 21.33. Дистальна резекція підшлункової залози зі збереженням селезінки:
1 - кукса підшлункової залози; 2 - селезінка
З сучасних позицій ефективність оперативного втручання повинна оцінюватися не тільки частотою післяопераційних ускладнень, але і можливістю реабілітації оперованих хворих, відновлення втраченої функції і якістю життя пацієнтів. Панкреатодуоденальная резекція - технічно складне і травматично оперативне втручання, проте це єдино можливий спосіб радикального лікування пухлин головки ПЖ і продовження життя хворого.
Найбільш виражені адаптаційно-компенсаторні перебудови в органах гастропанкреатодуоденальной зони спостерігаються протягом перших 12 місяців післяопераційного періоду. Обстеження хворих в різні терміни після ПДР (особливо в перші шість місяців після операції) показує, що практично всі пацієнти на всіх термінах спостереження потребують комплексної медикаментозної терапії. У пацієнтів нерідко мають місце симптоми екзокринної недостатності ПЖ (здуття живота, бурчання, часті випорожнення, стеаторея), для корекції яких всім хворим необхідні ферментні препарати (зокрема, креон 25000 і 10000 ОД по 1-2 капсули з кожним прийомом їжі). Пацієнтам з недостатніми показниками стану харчування (які мають дефіцит маси тіла, який розраховується за значенням індексу маси тіла) показана нутріціонной підтримка (анаболічні гормони, харчові суміші або коктейлі для ентерального харчування), пробіотики при виявленні дисбактеріозу кишечника.
Наші дослідження показали, що проведена терапія, що включає ферментні, антисекреторні препарати, октреотид, антациди, пробіотики, гепатопротектори, сприяє поступовому підвищенню якості життя протягом року після панкреатодуоденальной резекції. Зокрема, достовірно зменшується частота болю (майже в 3 рази до кінця першого року після ПДР), зменшується число хворих з дефіцитом маси тіла. У 75% хворих, які отримують зазначену терапію, нормалізується стілець і відзначаються нормальні показники копрограми.
Оцінка якості життя прооперованих хворих (за допомогою міжнародних опитувальників) продемонструвала, що рівень стану загального здоров'я і показників якості життя поступово підвищується протягом 12-24 місяців після операції.
Після панкреатодуоденальной резекції у ряду хворих (за даними різних авторів, 10-20%) в післяопераційному періоді вперше діагностується цукровий діабет, що також вимагає відповідної корекції (призначення дієти, цукрознижувальних препаратів або інсулінотерапії).
Порівняльна оцінка найбільш поширених варіантів ПДР переконливо не виявила явних переваг або недоліків різних модифікацій. З функціональної точки зору пілоруссохраняющая панкреатодуоденальная резекція і класична операція Уиппла (гастро панкреатодуоденальпая резекція) рівнозначні.
Таким чином, при відповідному лікуванні вже через рік навіть після такої травматичною операції, як ПДР, більшість хворих відчувають себе цілком задовільно, якщо немає прогресування пухлинного процесу.
Як зрозуміло з викладеного, результати хірургічного лікування РПЖ не можна вважати задовільними. Це змушує шукати додаткові методи лікування. До них відносять хіміотерапію і променеву терапію.
Основним хіміопрепаратом, використовуваним для лікування раку ПЖ, виступає 5-фторурацил, його також застосовують у поєднанні з лейковорі- ном (похідним фолієвої кислоти). Останнім часом препаратом вибору виявляється гемцитабін (гемзар). Регіонарне введення хіміопрепаратів при раку головки підшлункової залози шляхом селективної катетеризації під контролем рентгенотелевіденія або ж під час операції, за деякими даними, збільшує терапевтичний ефект і дозволяє зменшити дозу хіміопрепарату, що вводиться системно.
Променеву терапію при раку підшлункової залози використовують протягом останніх двох десятиліть. При цьому сумарна вогнищева доза становить 50-60 Грей. При невеликих резектабельності пухлинах можливе проведення передопераційної променевої терапії великими фракціями з наступною резекцією. Це дозволяє збільшити абластічность операції і в ряді випадків поліпшити віддалені результати.
Перспективна интраоперационная променева терапія. Комбінований (променева терапія і резекція) і комплексний підходи (ізольована хіміопроменева терапія, або резекція і хіміопроменева терапія, або резекція і хіміотерапія) дають можливість помітно поліпшити віддалені результати лікування.