| Головна |
| «« | ЗМІСТ |
|---|
Рак стравоходу займає 13-е місце в структурі онкозахворюваності та 7-е місце в структурі смертності серед усіх злоякісних пухлин. Проте рак стравоходу відноситься до високозлоякісних пухлин і характеризується раннім лімфогенним метастазуванням. У хірургічній клініці рак стравоходу - найчастіше захворювання цього органу, рак становить 80-90% всіх захворювань стравоходу.
Резектабельность залишається на досить низькому рівні. При местнора- спространеіном раку вона коливається від 22 до 53%. Не можна не відзначити низький відсоток операбельности онкологічних хворих, що не перевищує в нашій країні 60%. Стримуючими факторами виступають поширеність пухлинного процесу, похилий вік хворих, наявність супутніх захворювань і т. Д.
Незважаючи на досягнуті успіхи в зниженні післяопераційної летальності, віддалені результати лікування раку стравоходу залишаються невтішними. П'ятирічна виживаність становить, за різними даними, 5-20%.
Тривають дослідження щодо поліпшення віддалених результатів лікування цього грізного захворювання. Вважається, що одним з методів, що сприяють поліпшенню віддалених результатів хірургічного лікування, виступає розширена лімфодіссекція (видалення лімфатичних вузлів). Прихильники цієї операції як аргумент наводять той факт, що метастатична поразка лімфатичних вузлів спостерігається більш ніж в половині випадків. При цьому в 40-60% лімфатичне мета- стазірованіе відбувається в лімфовузли, розташовані нижче діафрагми.
В останні роки активно обговорюється питання про застосування неоад'- юваптіой терапії в комбінованому лікуванні раку стравоходу. Однак за результатами кількох сучасних досліджень не отримано доказів позитивного впливу передопераційної хіміопроменевої терапії на результати лікування хворих аденокарциномами стравоходу.
Етіологія і патогенез. До загальновизнаних факторів ризику розвитку раку стравоходу відносяться: куріння тютюну (у курців зі стажем ризик розвитку плоскоклітинного раку стравоходу в 10 разів вище, ніж у некурящих, а аденокарциноми - в 2 рази), вживання алкоголю, особливості харчування (прийом гарячої їжі і рідин, їжа всухом'ятку, вживання висівок або проса з високим вмістом кремнезему, злиденна з високим вмістом таніну, низький вміст вітамінів, особливо групи В), ожиріння, синдром Пламмер - Вінсона (тріада: порушення ковтання, залізодефіцитна анемія і глосит), хімічні опіки стравоходу в анамнезі, ахалазія стравоходу, стравохід Барретта, тілоз (генетично детермінований аутосомно-домііантний ознака, що визначає розвиток долонно-підошовного гіперкератозу).
Стравохід Барретта - ціліндроклеточную метаплазия слизової оболонки стравоходу, що супроводжується виразкою або його стриктурою. Найбільш значимий фактор у розвитку стравоходу Барретта - шлунково-ніщеводний рефлюкс. Факторами ризику трансформації стравоходу Барретта в аденокарциному виступають наявність грижі диафрагмального отвори, протяжність ураження стравоходу і наявність дисплазії. У метаплазірованном клітинах дистального відділу стравоходу Барретта можливі мутації, що призводять до трансформації циліндричного епітелію в ділянки дисплазії. Дисплазія характеризується порушенням залозистої структури, гіперхроматізмом і нерівномірним скупченням ядер клітин.
Патогенез раку стравоходу остаточно не ясний. З експериментальних досліджень на тваринах можна припустити, що окисні порушення, зумовлені такими факторами, як куріння, шлунково стравохідний рефлюкс, викликають запальні зміни, езофагіт, прискорення клітинного циклу, що в сукупності може ініціювати канцерогенез. Після виникнення пухлини прогресування захворювання відбувається швидко.
Класифікація. згідно гістологічної класифікації, основна морфологічна форма раку стравоходу - плоскоклітинний рак (орогове- вающий або неороговевающий) - 95% випадків, в 5% випадків спостерігається аденокарцинома. До рідкісних гістологічним форм злоякісних пухлин відносяться різні різновиди плоскоклітинного раку (веретеноклеточний рак, карциносаркоми), недиференційовані пухлини (дрібноклітинний рак), первинна лимфосаркома стравоходу, а також мезенхімальні і нейроендокринні пухлини. Однак в цілому ці морфологічні форми зустрічаються в 1-2% випадків злоякісного ураження органу.
Макроскопічно за типом росту виділяють:
шляхи метастазування раку стравоходу - лімфогенний, гематогенний, імплантаційний. Найчастіше віддалені метастази виявляються в печінці, легенях, кістках, головному мозку і надниркових.
Особлива будова лімфатичної системи зумовлює особливості лімфогенного метастазування при раку стравоходу: значна варіабельність напрямків метастазування різних відділів; відсутність сегментарного метастазування; поява пилоподібних внутрістеночних метастазів в стравоході, часто на значній відстані від первинної пухлини (до 8 см); поява «стрибаючих» метастазів (Skip metastasis) в лімфовузлах, які виявляються до 30% випадків. Під «стрибучими» метастазами слід розуміти метастатична поразка більш віддалених груп лімфатичних вузлів, розташованих в наступному етан метастазування, при интактности ближчих до пухлини груп лімфовузлів.
Переважання поздовжнього вектора метастазування над поперечним визначає можливість ураження будь-якої групи лімфоколлекторов при локалізації пухлини в різних відділах стравоходу. Однак відзначено, що рак шийного і верхнегрудного відділів стравоходу найбільш часто мета- стазірует в лімфатичні вузли верхнього середостіння, а також шейнонадключічной області (шийні, медіастинальні, над- і підключичні лімфатичні вузли); рак середньогрудного відділу практично з однаковою частотою метастазує як в медіастинальні, так і в абдомінальні лімфоколлекторов; рак нижнегрудного відділу частіше метастазує в пара- кардіальні і заочеревинні лімфатичні вузли басейну лівої шлункової артерії і черевного стовбура, а також в лімфатичні вузли заднього середостіння до рівня біфуркації трахеї.
Міжнародна класифікація раку стравоходу відповідно до системи TNM (Див. Прим, на с. 71):
- Т - первинна пухлина:
ТХ - первинна пухлина не може бути визначена;
ТО - в стравоході немає даних про первинної пухлини;
Tis - «Рак на місці», пухлина розташовується в межах слизового шару, не виходячи за власну пластинку;
Т1 - пухлина проростає власну пластинку:
Т1а - проростає власну пластинку або м'язову пластинку слизової оболонки;
Т1Ь - проростає в підслизову основу;
72 - пухлина поширюється в м'язову оболонку, але не проростає її;
ГГЗ - пухлина проростає адвентициальную оболонку;
Т4 - пухлина проростає прилеглі тканини і органи:
Т4а - РЕЗЕКТАБЕЛЬНОМ пухлина, яка поширюється на плевру, перикард, діафрагму;
Т4Ь - нерезектабельних пухлина, що проростає аорту, тіла хребців, трахею;
- N - регіонарні лімфатичні вузли:
NX - регіонарні лімфатичні вузли нс можуть бути оцінені;
N0 - відсутні метастази в регіонарних лімфатичних вузлах;
N1 - метастази в 1-2 регіонарних лімфатичних вузлах;
N2 - метастази в 3-6 регіонарних лімфатичних вузлах;
N3 - метастази в 7 і більше регіонарних лімфатичних вузлах;
- М - віддалені метастази:
MX - недостатньо даних для оцінки віддалених метастазів;
МО - відсутність віддалених метастазів;
М1 - наявність віддалених метастазів.
критерій М1 підрозділяється на М1а і М1Ь в залежності від локалізації пухлини в стравоході.
Для пухлин верхнегрудного відділу стравоходу:
М1а - метастази в шийних лімфовузлах;
М1Ь - інші віддалені метастази.
Для пухлин середньогрудного відділу стравоходу:
М1а - в класифікації не визначено;
М1Ь - метастази в нерегіонарних лімфатичних вузлах і (або) віддалених органах.
Для пухлин нижнегрудного відділу стравоходу:
М1а - метастази в чревного лімфовузлах;
М1Ь - інші віддалені метастази.
Для грудного відділу стравоходу, включаючи верхнегрудной відділ, шийні лімфатичні вузли не виступають регіонарними (М1а). Для шийного відділу стравоходу регіонарними вважаються тільки шийні лімфатичні вузли (N1), А метастази в медіастинальної і черевних лімфовузлах розцінюються як віддалені (М1).
Групування за стадіями представлена в табл. 10.1.
Таблиця 10.1
Групіровка раку стравоходу за стадіями
|
стадія |
характеристика по TNM (Див. Прим, на с. 71) |
||
|
первинна пухлина |
регіонарні лімфатичні вузли |
віддалені метастази |
|
|
0 |
Tis |
N0 |
МО |
|
I |
Т1 |
N0 |
МО |
|
на |
Т2 |
N0 |
МО |
|
ТЗ |
N0 |
МО |
|
|
іь |
Т1 |
N1 |
МО |
|
Т2 |
N1 |
МО |
|
|
III |
ТЗ |
N1 |
МО |
|
Т4 |
Будь-яка N |
МО |
|
|
Iа |
Будь-яка Т |
Будь-яка N |
М1а |
|
IV /; |
Будь-яка Т |
Будь-яка N |
М1' |
Клінічна картина. Клінічні симптоми раку стравоходу можна розділити на три групи:
До первинним симптомів відносяться дисфагія, болі за грудиною, сри- гіваніе їжею (регургітація), гіперсалівація. Практично всі ці симптоми свідчать про досить великому поширенні патологічного процесу по стравоходу.
Типові симптоми раку стравоходу обумовлені феноменом обтурації. Найбільш яскравим з них виявляється дисфагія - утруднення проходження їжі по стравоходу. Дисфагія обумовлена звуженням просвіту органа зростаючої пухлиною (механічна дисфагія), але іноді вона залежить від спазму в верхніх відділах стравоходу (рефлекторна дисфагія).
Механічне порушення проходження їжі по стравоходу проявляється відчуттям грудки або «кола» за грудиною, а перші епізоди нерідко супроводжуються відчуттям задухи і страхом. При цьому відчувається хворим рівень перешкоди часто не відповідає істинному розташуванню стенозу в стравоході.
У більшості випадків дисфагія наростає поступово, але завжди відрізняється неухильним прогресуючим перебігом. Спочатку з'являється ледь помітна затримка при проходженні по стравоходу твердої їжі. Хворий як би відчуває твердий харчова грудка, просувається по стравоходу. Звуження прогресує, і незабаром хворий змушений запивати тверду їжу ковтком води або відмовлятися від прийому других страв. Надалі, через кілька тижнів або місяців, перестає проходити напіврідка їжа, а потім і рідина.
Таке послідовне розвиток дисфагії спостерігається не завжди. Іноді в результаті розпаду пухлини або медикаментозного лікування прохідність стравоходу частково або повністю відновлюється. Поліпшення стану триває недовго, і незабаром дисфагія знову починає прогресувати.
Прямими наслідками дисфагии стають відрижка, регургітація застійного вмісту стравоходу в глотку і поява неприємного запаху з рота. Гикавка при раку стравоходу може відзначатися на самих ранніх стадіях, у вигляді окремих епізодів, ще до появи стійкої дисфагии.
Виділяють чотири ступені дисфагії (див. Параграф 9.2).
Біль при ковтанні (одінофагія) носить розпираючий, спастичний або пекучий характер, локалізується за грудиною, в області мечоподібного відростка або навіть - при локалізації пухлини в нижній третині стравоходу - у верхніх відділах живота. Локалізація болю зазвичай не відповідає рівню ураження стравоходу: частіше біль проектується нижче пухлини. Наявність одінофагіі обумовлено, мабуть, сунерінфскціей або лікарським езофагітом.
Біль, не пов'язана з прийомом їжі, локалізується в грудях, в хребті або в області серця, нерідко іррадіюючи в міжреберні проміжки, в межлопаточную або надключичную область, в шию по ходу т. stemocleidomastoideus або в нижню щелепу. Характерна іррадіація болю іноді дає привід підозрювати стенокардичні її походження.
Важливо при цьому зазначити, що застосування нитропрепаратов через відсутності адресності їх релаксирующего дії на гладку мускулатуру може в ряді випадків раку стравоходу не тільки пом'якшувати больовий синдром, але і зменшувати прояви дисфагії. Такий же дезориентирующий ефект можуть давати м-холінолітики (атропін).
Важливі для діагностики регургітація їжі і пищеводная блювота. Регургітація частіше обумовлена спазмом, вона виникає відразу після прийому їжі. Стравохідна блювота проявляється при вираженому стенозі через деякий час після їжі. Регургітація поряд з іншими диспепсичними розладами (відрижка, печія, нудота) у деяких хворих може бути першим симптомом захворювання.
В окремих випадках досить рано виникає патологічно рясне слиновиділення (Гіперсалівація, слинотеча, сіалорея), але частіше воно зустрічається при вираженому стенозі. Його найбільш поширене пояснення полягає в тому, що їжа не надходить в шлунок, а тому не переривається вагусний слиновидільний рефлекс. Стимулювання секреції слини пов'язано з рефлекторною активністю пп. vagi, лежать безпосередньо на стравоході і здатних залучатися до пухлинний процес незалежно від обтурації просвіту. Можливо, таким чином, сіалорея виявляється критерієм проростання пухлиною адвентиции стравоходу або результатом здавлення вегетативних волокон.
Поряд з перерахованими ознаками рак стравоходу може супроводжуватися неприємним або навіть смердючим запахом з рота, який залежить від розпаду пухлини і гнильних процесів вище звуження і відчувається самим хворим або вловлюється оточуючими.
вторинні симптоми відносяться до пізніх проявів раку стравоходу. Вони свідчать про ускладнення хвороби внаслідок виходу процесу за межі стравоходу:
Ураження легень в більшості випадків спостерігається на пізніх стадіях захворювання і характеризується рецидивуючими легеневими інфекціями, що розвиваються внаслідок аспірації або освіти стравохідно-респіраторного свища. Блювота кровио виникає в результаті розпаду пухлини (блювота кавовою гущею) або аррозии судин стравоходу (наявність незміненій крові в блювотних масах). Рак стравоходу може ускладнюватися утворенням параезофагеальние абсцесу і медіастиніту, стравохідного свища, ателектазу і пневмонії, гангрени легкого, плевриту і ніопневмоторакса, перикардиту, руйнуванням тіл грудних хребців зі здавленням спинного мозку і нижньої параплегией. Відомі казуїстичні спостереження незвичайних маніфестацій раку стравоходу, наприклад профузного, смертельного кровотечі зі зруйнованої пухлиною аорти.
з загальних симптомів, властивих злоякісним новоутворенням внутрішніх органів, при раку стравоходу спостерігається прогресуюча втрата маси тіла, аж до кахексії, наростаюча загальна слабкість, стомлюваність, анемія.
Фізикальне обстеження зазвичай малоинформативно. Лімфаденопа- ку, особливо в лівій надключичній ямці (надключичні метастаз Вірхова, описаний при раку шлунка), виступає достовірною ознакою занедбаності процесу, коли радикальна операція вже нездійсненна. Гепатомегалия і наявність плеврального випоту теж свідчать про прогресування захворювання.
Інструментальна діагностика. Обстеження хворого з підозрою на рак стравоходу, як правило, починають з фіброезофагоскопія. Інші ендоскопічні методи дослідження включають фіброгастроскоп (якщо можливо провести ендоскоп за місце пухлинного звуження) і тра- хеобронхоскопію.
Фіброезофагоскопія з біопсією і наступним гістологічним дослідженням матеріалу дозволяє при наявності пошкодження слизової оболонки поставити правильний діагноз практично в 100% випадків.
фиброгастродуоденоскопия при ранніх карцинома стравоходу (коли можливо провести ендоскоп за пухлина) дозволяє оцінити стан шлункової стінки і виключити або констатувати наявність супутньої патології (хронічних виразок шлунка і 12-палої кишки, наявність стенозу вихідного відділу і т. д.).
При ураженні грудного відділу стравоходу на рівні біфуркації трахеї і вище показана фибробронхоскопия з метою виключення проростання трахеобронхіального дерева (її виконують пізніше, коли вже виконано рентгенологічне дослідження стравоходу).
Ультразвукове дослідження (УЗД) черевної порожнини виконується з метою візуалізації осередкового ураження печінки, оцінки стану абдомінальних лімфовузлів, виявлення асциту. В останні роки в клінічну практику впроваджено ендоскопічна ультрасонографія, що представляє собою внутрішньопросвітний УЗД стінки стравоходу за допомогою спеціального датчика, який вмонтовано в наконечник ендоскопа. Вона дозволяє визначити глибину інвазії стінки стравоходу в 83-86% випадків і поразки медіастинальної лімфатичних вузлів - в 60-76% випадків.
поліпозиційної рентгенографія стравоходу з використанням контрастують речовин дозволяє оцінити протяжність пухлини і стан стравоходу і шлунка нижче пухлини, чого часто неможливо зробити ендоскопічно, так як апарат не проходить нижче пухлини і можна оглянути тільки її верхню частину.
З контрастних препаратів найбільш часто використовується водна суспензія сірчанокислого барію спочатку рідкої, а при гарній прохідності стравоходу - густої консистенції. За променевим ознаками можна виділити ендофітну форму раку стравоходу, екзофітну, полипозную або змішану. Залежно від форми пухлини визначається різна картина «дефекту наповнення» стравоходу як одного з основних променевих ознак пухлини.
Екзофітний рак зростає переважно в просвіт органа, утворюючи при традиційному рентгенологічному дослідженні дефект наповнення з безперервними, горбистими контурами (рис. 10.2).
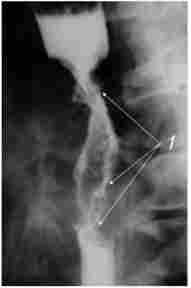
Мал. 10.2. Рентгенограма екзофітної пухлини1
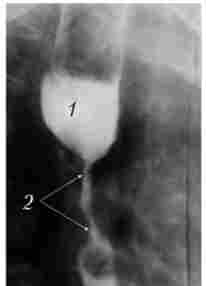
Мал. 103. Рентгенограма сунрастенотічного розширення стравоходу2:
1 - компенсаторное розширення просвіту стравоходу; 2 - пухлина стравоходу
При циркулярному поширенні пухлини стравохід на цій ділянці стає звуженим, утворюючи «раковий канал». Над звуженням, як правило, визначається супрастенотічне розширення (рис. 10.3).
Перехід від здорового ділянки до ураженого буває стрімким, ступенеобразно. На рівні пухлини визначається ригідність з Тенков, відсутність перистальтики внаслідок проростання пухлини в м'язовий шар стінки стравоходу. У ряді випадків попутна інформація про поширеність раку стравоходу може бути отримана при комп'ютерної томографії, яка може свідчити про медиастинальной і абдомінальної лімфаденопатії.
При підозрі на внутрішньо грудний і внутрішньочеревний поширення ракового процесу з залученням оточуючих структур, наявність лімфогенних і гематогенних метастазів проводиться мультиспіральному комп'ютерно-томографічне дослідження (МСКТ). Метод характеризується високою чутливістю і специфічністю. МСКТ - обов'язковий елемент передопераційного стадіювання поширеності процесу.
Один із сучасних методів передопераційного обстеження місцевої і системної поширеності пухлинного процесу - позитронно емісійна томографія (ПЕТ). Вона дозволяє визначити стан первинної пухлини, її зв'язок з оточуючими органами і структурами, наявність регіонарних і віддалених метастазів.
Диференціальна діагностика. Диференціальну діагностику раку стравоходу слід проводити з доброякісними пухлинами стравоходу. Найчастіша доброякісна пухлина - лейоміома (див. Параграф 10.1).
Найважче відрізнити початкові стадії инфильтративного раку стравоходу в нижнегрудном відділі від кардіоспазм (Ахалазії стравоходу) (див. Параграф 9.2).
У сумнівних випадках для виявлення прохідності кардії застосовують пробу Кона (додатковий прийом 200-500 мл рідини) або пробу Херста (заповнення стравоходу барієвої суспензією до рівня дуги аорти).
Особливе діагностичне значення має фіброезофагоскопія, при якій лікар бачить розширений стравохід із залишками їжі в його просвіті. При цьому ендоскоп проходить в шлунок. У поєднанні з біопсією ендоскопічний метод оказиватся остаточним в доопераційному розпізнаванні ракового переродження.
клінічна картина езофагіту, крім дисфагії, в основному проявляється болем в епігастрії, що підсилюється під час їжі і при вживанні грубої і гострої їжі. При фіброезофагоскопія виявляється гіпере- мировалось і набрякла слизова оболонка, іноді з ерозіями на поверхні в період загострення. При хронічному езофагіті слизова оболонка стравоходу атрофична, бліда, відзначається деяка ригідність стінок в зв'язку з рубцевими змінами в м'язовому шарі.
часто зустрічаються рубцеві звуження стравоходу після хімічних опіків зазвичай неважко відрізнити від раку стравоходу. Набагато важче виявити на тлі рубців в стравоході початкові прояви раку. Дозволити сумнів допомагає гістологічне дослідження тканин, отриманих з стінки стравоходу при езофагоскопії.
Більш рідкісні захворювання стравоходу, такі як первинно укорочений стравохід, склерозуючий медиастинит, який втягує в процес стравохід, також треба мати на увазі при диференціальної діагностики раку стравоходу.
Лікування раку стравоходу. Лікування хворих на рак стравоходу - одна з найскладніших завдань клінічної онкології.
Радикальне лікування сьогодні - це комбіноване (видалення пухлини і променева терапія (ЛТ)) або комплексне (видалення пухлини і хіміотерапія, або ще і ЛТ) лікування, яке крім хірургічного видалення пухлини включає ад'ювантні (післяопераційні) або нео- ад'ювантні (доопераційні) впливу.
сучасні радикальні операції при раку стравоходу можна розділити на два типи:
При резекції лінія перетину стравоходу знаходиться на певній відстані (зазвичай 4-6 см) від верхнього краю пухлини. Субтотальная езофагектомія передбачає майже повне (за винятком невеликої ділянки шийного відділу) видалення стравоходу незалежно від локалізації пухлини.
Залежно від вибору оперативних доступів виділяються наступні основні види втручань:
На сучасному етапі активно розробляються внутріпросветние ендоскопічні та ендовідеохірургічним операції.
В даний час загальновизнано виконання при раку стравоходу одномоментних операцій. Як пластичного матеріалу для езофагопла- стіки перевагу віддають використанню шлунка, при цьому застосовується як цілий шлунок, так і викроєний клапоть з великою його кривизни. Шлунковий трансплантат формується з урахуванням внутрішньоорганного межсосудістого анастомозірованія основних судинних колекторів шлунка.
Після детального вивчення екстра-та інтраорганних кровопостачання шлунка в умовах його мобілізації було виявлено, що на тлі існуючого внеор- гапного колатерального судинного русла, в найбільшою мірою вираженого по великій кривизні, але носить непостійний характер, і численних безсистемних анастомозів є строго топографоанатомічному окреслена внутріорганная судинна магістраль між трьома основними судинними колекторами шлунка (A. Gastroepiploica dextra, a. Gastrica sinistra, a. gastroepiploica sinistra) через систему судин першої та другої гілок спадного відділу лівої шлункової артерії.
При цьому ramus transversus через свої гілки виступає сполучною інтраор- ганним межсосудістим Анастомозирует стволом між системами a. gastrica sinistra і a. gastroepiploica sinistra, а друга гілка спадного відділу лівої шлункової артерії - між a. gastrica sinistra і a. gastroepiploica dextra. Кінцева ланка даної магістралі - дві судинні гілочки, що відходять від проксимальної гілки a. gastroepiploica sinistra до апікальної частини дна шлунка.
На підставі отриманих даних розроблена методика формування шлункового трансплантата для езофагопластікі, заснована на повній цілості магістрального внутрішньоорганного судинного русла. Потім слід резекція кардіального відділу і малої кривизни шлунка з використанням зшивачів.
Попереднє (перед механічним прошиванням) розтягнення шлунка, з одного боку, значно покращує візуалізацію інтраорганіих судин, з іншого - до певної міри сприяє збільшенню довжини формованого трансплантата. Як правило, його загальна довжина від пілоричного жому до апікального відділу коливається в межах 25-27 см (рис. 10.4).
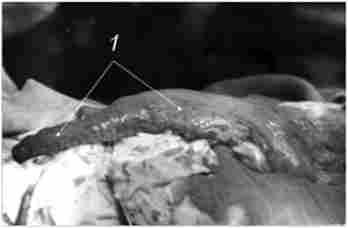
Мал. 10.4. Кінцевий вигляд сформованого трансплантата після занурення танталових швів серозно-м'язовими швами
Видалення кардії обумовлено, з одного боку, підвищенням радикалізму оперативного втручання при раковому процесі, а з іншого боку, формуванням трансплантата достатньої довжини. Крім того, за рахунок зменшення в розмірах площі проксимального відділу шлунка і моделювання трансплантата безпосередньо по ходу судин з найбільшим діаметром представляється можливим формувати трансплантат з оптимальним кровопостачанням, так як при цьому створюються найбільш вигідні умови між обсягом надходить кровотоку і площею живиться поверхні.
Абдомінальна лімфодіссекція здійснюється за принципом моноблочного висічення клітинних просторів і лімфатичного апарату лівої шлункової, чревной, загальної печінкової і селезінкової артерій. Далі приступають до торакотомії. Розріз здійснюється в V міжребер'ї справа з перетином хрящової частини вищого ребра по парастернальной лінії. Мобілізація стравоходу з пухлиною здійснюється з перетину стравоходу вище пухлини (не менше ніж на 6-7 см), лігування грудного лімфатичного протоку над діафрагмою і на рівні непарної вени. Тільки після цього приступають до мобілізації стравоходу, починаючи з етапу відділення його від аорти.
Стравохід видаляється разом з параезофагеальной клітковиною, біфуркаційних, паратрахеальние і трахеобронхіального лімфатичними колекторами.
Завершальна стадія операції - формування інвагінаціонний стравохідно-шлункового анастомозу по К. Н. Цацаніді із зануренням його в середостіння, в ложі віддаленого стравоходу, і відновленням цілісності парієтальної плеври від купола плевральної порожнини до пересіченій непарної вени.
У ряді випадків, коли пухлина локалізується в верхнегрудном сегменті стравоходу, з урахуванням необхідності «відступити» вище пухлини перед перетином стравоходу, накладення всередині грудного анастомозу може виявитися неможливим. Тоді роблять додатковий доступ па шиї, з якого перетинають стравохід і формують стравохідно-шлунковий анастомоз.
У випадках неможливості здійснити пластику стравоходу шлунковим трансплантатом в пластичних цілях використовують ободочную або тонку кишку.
Оптимальним і найбільш фізіологічним шляхом проведення трансплантата визнано заднє середостіння (ложе стравоходу). Ретростерналь- ний і антеторакальний шляху проведення трансплантата також мають право на існування, але частіше їх використовують при неможливості проведення трансплантата через заднє середостіння.
При резекції стравоходу стравохідний анастомоз, як правило, розташовується внутриплеврально, а при субтотальної езофагектоміі - тільки внеплевральном (на шиї).
Новою тенденцією стали пластичні пересадки вільних трансплантатів з використанням мікросудинних анастомозів.
При резекції шийного відділу стравоходу, що супроводжується видаленням гіпоглоткі і гортані, вдаються до вільної трансплантації двох кишкових сегментів: толстокишечного і толстокишечную-клубового - для відновлення глоткової-стравохідного дефекту і для відновлення голосової функції.
Вибір методу лікування залежить від локалізації пухлини і її поширеності. Неоперабельними хворі бувають з двох причин:
При раку шийного і верхнетрудного відділів стравоходу пухлина швидко проростає навколишні органи і рано дає метастази. Рак цієї локалізації більш успішно лікують за допомогою променевої терапії.
При раку грудного відділу стравоходу виконують одномоментну субтотальную резекцію стравоходу з пластикою його шлунком з внутріплевраль- ним стравохідним соустя (операція Лиоіса). При раку нижнього відділу стравоходу теж зазвичай виробляють таке втручання, хоча іноді застосовують резекцію нижньої третини стравоходу, проксимального відділу шлунка і малого сальника з лівостороннього торакоабдомінальної доступу (операція Герлока).
З метою поліпшення результатів лікування, як уже зазначалося, радикальне оперативне втручання доповнюють променевою терапією, нерідко фармакомодулірованной (з одночасним введенням протипухлинних хіміопрепаратів), фотодинамічної терапії (ФДТ), кріотерапією.
При іеудалімих пухлинах виробляють паліативні втручання з метою відновлення прохідності стравоходу і (або) поліпшення харчування хворого. До них відносять гастростомію, паліативні резекції стравоходу.
з малоінвазивних паліативних методів лікування раку стравоходу, спрямованих на відновлення можливості прийому їжі, сьогодні широко розробляються і використовуються ендоскопічні методи реканалізації пухлини. До них відносяться: бужування, електрокоагуляція, реканалізація просвіту стравоходу високоенергетичним лазером, фотодинамічна реканалізація низькоенергетичним лазером, інтубація пухлини жорсткими протезами, інтубація пухлини саморозширювальні стентами, інтратуморальное введення цитостатиків. Вибір того чи іншого методу визначається можливостями та досвідом персоналу конкретного лікувального закладу.
Бужування пухлинної стриктури - одне з традиційних і найдоступніших методів лікування. Однак його можливості дуже обмежені, а ризик ускладнень дуже високий. Рівень ускладнень може досягати 30%, в тому числі перфораций - 10%.
Аргоно-плазмова або біполярна електрокоагуляція увазі пряму коагуляцію пухлини під ендоскопічним контролем. Лікування буває ефективним більш ніж в 80% випадків при частоті ускладнень близько 8% (в основному за рахунок перфорацій).
В останні 10-15 років широкого поширення набула методика реканалізації стравоходу за допомогою лазерної коагуляції пухлини. Головний недолік лазерної терапії - необхідність частого повторення процедур. Відсоток перфораций при цьому також досить високий (8%).
Деякий час назад інтенсивно розвивалася фотодинамічна терапія (ФДТ), яка полягає у внутрішньовенному введенні в організм пацієнта фотосенсибилизаторов, які накопичуються в тканини пухлини, з подальшим впливом на пухлину низькоенергетичним лазерним променем. І хоча при раку стравоходу метод застосовується в основному для лікування ранніх пухлин, з'явилися дані по використанню його також в цілях боротьби з дисфагією.
Головний недолік всіх перерахованих симптоматичних методик - короткочасність ефекту, що досягається. Найбільш перспективним напрямком сьогодні є інтубація (стентування) пухлини. У 1990 р був винайдений дротяний саморозширюється стент з внутрішнім діаметром до 20-25 мм. До недоліків стентів відноситься можливість їх зміщення в момент установки, обтурація пухлинними розростаннями по краях, здатність ковзання в дистальному напрямку в міру обростання колагеном, трудність видалення або передислокації, висока вартість.
променеву терапію застосовують в комплексі з оперативним лікуванням до і після операції, а при неоперабельном раку - в якості самостійного виду лікування або в поєднанні з хіміотерапією. При застосуванні поєднаної променевої терапії при раку стравоходу рівень п'ятирічної виживаності підвищується до 36-38%, що відповідає показникам при радикальних операціях, виконаних па ранніх стадіях.
При аденокарцинома стравоходу променева терапія неефективна. Протипоказана променева терапія при важких захворюваннях серцево-судинної і дихальної систем, паренхіматозних органів, центральної нервової системи, розпад пухлини, кровотечі.
При неможливості виконання хірургічного або променевого лікування при раку стравоходу може бути застосована в якості паліативного засобу хіміотерапія (Комбінація антиметаболітів піримідинового ряду (5-фторурацил або фторафур) з метатрексатом і колхамін). Хіміотерапія раку стравоходу до теперішнього часу малоефективна в зв'язку з низькою чутливістю пухлини до відомим протипухлинних препаратів і поганим кровопостачанням органу. Однак повністю ігнорувати роль хіміотерапії в лікуванні хворих на рак стравоходу не можна.
Післяопераційне ведення хворих. Ведення хворих після резекції стравоходу - складне завдання. Велику роль відіграють: початковий стан хворого до операції, його вік, наявність супутніх захворювань і ступінь їх тяжкості, безпосередньо обсяг операції, розтин двох або трьох порожнин (черевної, однієї або двох плевральних), симультанний характер операції, тривалість хірургічного втручання, обсяг інтраопераційної крововтрати . Основні принципи післяопераційної інтенсивної терапії:
У відділеннях хірургічної реанімації проводять корекцію гіпово- леміі, електролітних і метаболічних розладів, білкової недостатності за прийнятими схемами лікування реанімаційного хворого.
Прогноз. Серед безлічі факторів, що впливають на виживаність хворих, які перенесли резекцію стравоходу з приводу раку, основними виступають:
При відсутності можливості радикального лікування прогноз завжди безнадійний, і середня тривалість життя після встановлення діагнозу становить 5 10 міс.
Чим менше розміри пухлини і ступінь регіонарного метастазірова- ня, тим краще показники 5-річного виживання.