| Головна |
| «« | ЗМІСТ | »» |
|---|
розрізняють екстенсивну і інтенсивну регуляцію активності ферментів в клітинах і тканинах організму. Екстенсивна регуляція обумовлена індукцією або репресією генів, що кодують синтез відповідних ферментів. Збільшення або зменшення числа активних молекул визначає сумарну активність пулу даного ферменту в будь-якому компартменте клітини, в тканини або цілому органі. У фізіологічних умовах вміст того чи іншого ферменту в клітині постійно і регулюється двома процесами: швидкістю його синтезу і розпаду. Обидва ці процеси взаємопов'язані і контролюються на генному рівні. Збільшення швидкості синтезу ферментативного білка обумовлює активацію внутрішньоклітинних протеїназ та прискорений розпад «старих» молекул ферменту, а зниження швидкості синтезу призводить до уповільнення розпаду ферментативного білка.
Інтенсивна регуляція пов'язана зі зміною активності зрілих, що функціонують молекул і визначається різноманітними молекулярними механізмами.
термін аллостерічеський утворений від грецьких слів: аліос - інший і стереос - просторовий. Існує ряд ферментів, що мають в своєму складі, крім активного центру, так званий аллостерічеський центр, приєднання до якого певних хімічних речовин - ефекторів - призводить до зміни конформації білкової глобули і, як наслідок, модифікації ферментативної активності. Молекули аллостерічних ферментів містять набори як активних, гак і аллостерічних центрів, причому з аллостеричним центром може з'єднуватися як субстрат, так і ефектор, що відрізняється за будовою від субстрату.
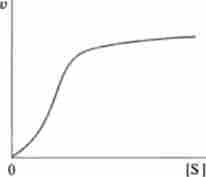
Мал. 6.13. Крива залежності швидкості ферментативної реакції від концентрації субстрату, характерна для аллостерічних ферментів
У першому випадку взаємодія є гомотроп- іим, у другому - гетеротропним. Просторова відокремленість активних і аллостерічних центрів зумовлена наявністю четвертичной структури, характерної для аллостерічних ферментів. Аллостерічеськіє взаємодії найбільш яскраво проявляються в характері кривих залежності швидкості ферментативної реакції від концентрації субстрату.
Замість гіперболічної кривої, що підкоряється закономірностям Міхаеліса-Мснтсн, для аллостерічних ферментів характерна сігмоідной крива, представлена на рис. 6.13. Як видно з малюнка, при малих концентраціях субстрату швидкість ферментативної реакції набагато нижче, ніж для звичайних ферментів в рівних умовах.
Приєднання лиганда до аллостерічному центру ферменту змінює швидкість реакції, причому якщо швидкість реакції зростає, то такий ефектор називають позитивним, якщо знижується - негативним.
Аллостерічеськіє ферменти складаються як мінімум з двох ідентичних субодиниць, кожна з яких має один активний і один регуляторний (аллостерічеський) центри. При взаємодії субстрату або ефектора з ферментом відбувається зміна конформації однієї з субодиниць, що викликає модифікацію вищих структур другий субодиниці. Конформаці- онние перетворення обумовлюють зміни каталітичної активності молекули ферменту.
Механізм дії аллостерічних ферментів має багато спільного з процесом приєднання кисню до гемоглобіну (гл. 3).
В обох випадках приєднання ліганду призводить до зміни конформації білкових субодиниць і зміни швидкості реакції.