| Головна |
| «« | ЗМІСТ | »» |
|---|
Найбільш ефективно відбувається регуляція в так званих мульти- ферментних комплексах. Ці комплекси є кілька ферментів, які каталізують ряд узгоджених реакцій, причому кінцеві продукти однієї ферментативної реакції є вихідними субстратами для наступної ферментативної реакції. Розрізняють три типи мультиферментних комплексів:
У кожному мультіфсрмснтном комплексі є, принаймні, один аллостерічеський фермент, який здійснює регуляцію сумарною реакції всього ферментного ансамблю. Найчастіше цей фермент каталізує швидкість першої (найповільнішої) реакції, а його негативним модулятором є кінцевий продукт усього процесу в цілому.
Нижче представлена схема, яка зображує Мультиферментний систему, в якій продукт останньої реакції є негативним ефектором аллостерічного ферменту Е ,:
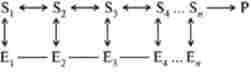
Мультиферментний системи можуть включати в себе до 20 різних ферментів, що функціонують в певній послідовності.
В даний час вивчені багато Мультиферментний комплекси, що функціонують на різних етапах метаболізму. Одним з таких комплексів є сукупність ферментів, які каталізують синтез піримідинів з ас- партата в бактеріальних клітинах. Аллостерічним ферментом в даному випадку є аспартат-карбомоілаза, що каталізує першу стадію процесу, а саме перетворення аспартату в карбомоіласпартат.
Регуляція ферментативної активності може здійснюватися за рахунок обмеженого протеолізу. Багато протеїнази, що функціонують поза клітинами, наприклад в крові або в травному тракті, синтезуються у вигляді неактивних попередників. Активація їх пов'язана з гідролізом деяких пептидних зв'язків в поліпептидного ланцюга. Як приклад можна привести ферменти згортання крові, а також такі ферменти травного тракту, як трипсин і хімотрипсин та ін.
Регуляція ферментативної активності може здійснюватися за рахунок ковалентного оборотної модифікації новосинтезованих білкових макромолекул. Це пов'язано в першу чергу з ферментативним приєднанням до них низькомолекулярних хімічних угруповань в результаті фосфорилювання, гликозилирования, метилування і т. Д. Приєднання фосфатної групи до гідроксилу амінокислотного залишку поліпептидного ланцюга може як збільшити, так і зменшити ферментативну активність. Прикладом тому може служити глікогенфосфорилази - фермент, що каталізує відщеплення залишків глюкози від глікогену. У початковому стані він неактивний, але при фосфорилировании, що здійснюється за допомогою ферменту протеїнкінази, відбувається його активація і залучення в процес метаболізму глюкози. Навпаки, фермент глікогенсінтази активний в початковому стані, а при фосфорилировании його активність різко знижується.
(Т) Ефективним інструментом регуляції каталітичної активності є молекулярна гетерогенність ферментів, обумовлена як генетичними, так і епігенетичними факторами.
В даний час близько половини ідентифікованих ферментів знаходяться в клітинах і тканинах у вигляді множинних молекулярних форм, що мають єдину субстратне специфічність, але відрізняються за фізико-хімічними або імунологічних властивостях. Генетична основа молекулярної гетерогенності обумовлена наявністю декількох генів, кожен з яких кодує одну субодиницю ферменту або одну його молекулярну форму. Крім того, різні молекулярні форми одного і того ж ферменту можуть кодуватися в одному генному локусі, що має множинні алелі. Генетично детерміновані молекулярні форми називаються ізоензимами. Посттрансляційні модифікації ферментів, зумовлені локальним протеолізом, ковалентними модифікаціями, бслок-білковими взаємодіями і т. Д., Є причиною утворення множинних молекулярних форм, які не є істинними ізоензимами, але грають істотну роль в метаболічних процесах. Найбільш часто зустрічаються так звані конформери - молекулярні форми, що мають однакову первинну структуру, але відрізняються за своєю конформації. Це можливо в тому випадку, якщо ці конформації досить стійкі, т. Е. Відповідають рівню вільної енергії, близькою до мінімальної. Тільки такі кон- формаційні варіанти білків, які відтворено фіксуються за допомогою електрофоретичних, хроматографічних чи інших методів, можуть рассмагріваться як конформери.