| Головна |
| «« | ЗМІСТ | »» |
|---|
Велика кількість хімічних сполук, які в міру їх появи необхідно перевіряти на генетичну активність, зумовило розробку простих, надійних і дешевих методів і тест-систем для скринінгу, або просіювання, великого числа з'єднань. Для виявлення мутагенів в цих тест-системах використовуються різні об'єкти і критерії. В даний час генетична активність речовин визначається за такими основними критеріями:
Крім того, застосовують такі критерії, як збільшення частоти домінантних ознак у дрозофіли і мишей і частота аномальних сперматозоїдів у мишей. Останні два тести не можуть належати строго до генетичних, проте їх результати добре корелюють з іншими тестами, заснованими на умовах пошкодження генетичного матеріалу.
Як об'єкти при масовому визначенні генетичної активності тих чи інших факторів використовують культури клітин людини і тварин, вищі рослини, мікроорганізми, О. melanogaster.
Тести з використанням мікроорганізмів відрізняються великою пропускною здатністю і чутливістю до мутагенних впливів. Вони дозволяють в повній мірі використовувати переваги селективних методів. Однак головна проблема при застосуванні цих тестів - можливість екстраполяції отриманих результатів на людину. Перевірка великої кількості з'єднань на мутагенну активність з використанням ссавців, наприклад мишей, неможлива через громіздкість і високу вартість експериментів.
Рішення проблеми було досягнуто при використанні тесту на мутагенну активність, опосередковану метаболічної системою господаря. У первинному варіанті цього тесту потенційні мутагени вводили в організм мишей чи пацюків, в перитонеальну порожнину яких поміщали тест-мікроорганізм: бактерії, дріжджі, конідії нейроспори, - у яких потім враховували мутації під впливом мутагенів, активованих ферментами тварин (табл. 13.2).
Таблиця 13.2
Тест-системи для швидкої оцінки генетичної аюівності хімічних сполук
|
об'єкти |
враховується ефект |
|
бактерії S. typhimurium E.coli |
реверсії His~ - His * стійкість Azc? - Azar індукція профага X |
|
мутації: |
|
|
гриби Sacch. cerevisiae |
Реверсії ауксотрофності мутантів «незаконне» спаровування АХА мітохондріальні мутації |
|
Schiz. pombe Asp. nidulans |
Реверсії ауксотрофності мутантів мутації по біосинтезу метіоніну |
|
рекомбінація: |
|
|
Sacch. cerevisiae |
Мітотична конверсія, митотичний кроссинговер |
|
Asp. nidulans |
митотичний кроссинговер |
|
Sacch. cerevisiae |
Анеуплоїдія і хромосомні перебудови: нерас- ходіння хромосом в мітозі Анеуплоїдія (облік по рецесивним селективним маркерами) розподілі і втрати III хромосоми (система: АХА) |
|
Asp. nidulans |
Втрати хромосом в мітозі у диплоидов у / + |
|
Вищі рослини Традесканція Боби |
Хромосомніаберації в кінчиках кореня |
|
Соматичні мутації: |
|
|
О. melanogaster |
Мозаїчність крил і очей |
|
Культура клітин ссавців Гепатощли щурів і ін. |
Одноцепочечниє розриви ДНК Позаплановий синтез ДНК |
|
Людина лімфоцити людини |
Цитогенетичні ефекти: хромосомні аберації, обміни між сестринськими хроматидами Генні мутації стійкості |
Надалі мутагенезу, опосередкований метаболічної системою господаря, був спрощений і став проводитися in vitro. Для цього мутаген наносять на чашки Петрі, засіяні тест-об'єктом, в суміші з ферментами мик- росомной фракції клітин печінки миші або щури. У цій фракції, що позначається S9, знаходиться цитохром 450, головна функція якого в організмі - детоксикація чужорідних сполук. Діючи на деякі так звані промутагени, система мікросомного окислення перетворює їх в мутагени.
У системах з метаболічної активацією промутагенів використовують не тільки мікросомного фракцію печінки, але і кров або сечу тварин і людини, а також екстракти з тканин вищих рослин.
Завдяки використанню детально розроблених мутаційних систем у мікроорганізмів відкриваються великі можливості не тільки для тестування мутагенної активності різних з'єднань, але і для з'ясування механізму їх дії. При цьому використовують мутантів з генетичними змінами певної молекулярної природи. Так, широке застосування знайшла тест-система, розроблена Б. Еймзом на основі Яі'-мутантів 5. ГурІутіпіт. Він використовував кілька мутантів типу заміни пар основ, а також типу вставок-випадінь пар основ по гистидинового оперон. Мутації об'єднуються з делецией по одному з генів, що контролюють ексцизійної репарацію, що підвищує чутливість тесту в кілька сотень разів. У геном тих же штамів введена мутація, що блокує утворення ліпополісахарідной капсули бактерій, завдяки чому підвищується проникність клітин. В клітини введені також плазміди - Л-фактори, які сприяють виявленню мутацій, що виникають як помилки рекомбінації.
Мутагенний ефект випробовуваних сполук визначається в так званому спот-тесті, для чого на чашки Петрі без гистидина, засіяні тест-штамом, наноситься досліджувана речовина разом з мікросомного фракцією гомогенату печінки миші для активації мутагенів. Поява Яї "-ревертантов свідчить про генетичну активності випробовується агента.
Завдяки використанню цієї системи показана тісна кореляція мутагенної активності і канцерогенності багатьох з'єднань, т. Е. Виявлення генетичної активності з'єднання одночасно з великою ймовірністю вказує на те, що воно потенційний канцероген. Б. Еймз показав мутагенну активність ряду речовин, які застосовуються в якості консервантів їжі, ряду барвників для волосся, сигаретного попелу, грибних токсинів (зокрема, афлатоксинов), бенз (а) пірену і ін.
Надалі підхід, розроблений Б. Еймзом, знайшов застосування і в роботі з іншими мікроорганізмами: бактеріями, дріжджами.
При вивченні мутагенезу під дією факторів, що забруднюють навколишнє середовище, необхідно відчувати складні суміші речовин, що включають органічні і неорганічні молекули. Крім того, навіть знаючи хімічну структуру сполуки, важко передбачити характер його мутагенної активності. У зв'язку з цим для випробувань запропоновано використовувати набір штамів одного і того ж мікроорганізму, що несуть мутації відомою молекулярною природи і специфічно реагують на дію еталонних мутагенів. Серед таких мутагенів, що застосовуються в експерименті в якості обов'язкового позитивного контролю, використовуються ультрафіолетове світло, етилметансульфонату, нитрозосоединения, р-пропіолактон, 6-гідроксіламінопурін і т. Д. У таких тестах виявлення мутагенної активності забруднювачів навколишнього середовища дозволяє грубо оцінювати механізм дії активного початку. Крім того, застосування серії штамів з різною локалізацією мутації дозволяє мінімізувати «ефект контексту» на мутагенез. Відомо, що мутації однаковою природи відбуваються з неоднаковою частотою в різних ділянках навіть одного і того ж гена.
Поряд з прокариотичними мікроорганізмами (бактеріями) в тест-системах часто використовують еукаріотичні мікроорганізми: гриби, дріжджі Зассе. сегес (з1ае, БсИг. Ротьє, нейроспори і аспергилл, в меншій мірі - водорості і найпростіших. У дріжджів, як і у бактерій, враховують прямі і зворотні генні мутації, застосовують метаболічну активацію, а крім того, дріжджі самі активують багато промутагени. На додаток до цього у дріжджів досліджують внутрігенних рекомбінацію (конверсію) і реципрокную рекомбінацію в мітозі. На основі генетичних критеріїв у цього об'єкта враховують також хромосомніаберації - втрату плеча або всієї III хромосоми, а також нерасхождение хромосом. Останній ефект зручніше досліджувати у Аспергилл, для якого добре розроблені методи аналізу нерасхожденія хромосом, що призводять до гап- лоідізаціі в парасексуальними циклі.
Генетична токсикологія не обмежується в дослідженнях тільки мікроорганізмами. Великий практичний інтерес представляють мутагенні ефекти у багатоклітинних тварин і в клітинах людини. Як багатоклітинного тваринного використовують дрозофілу, у якій враховують домінантні літали нерасхожденія і втрати хромосом в мей- озе, митотичний кроссинговер і виникнення мутацій в соматичних клітинах. В останньому випадку діють мутагенів на личинок і вивчають мозаїчність очей або крил як результат появи мутантних клонів в ході диференціювання імагінальних дисків.
До числа швидких тестів з використанням вищих рослин відноситься облік хромосомних аберацій в корінцях традесканції і ін.
Найбільш адекватною тест-системою повинна служити культура клітин людини, в якій враховують хромосомніаберації і обміни між сестринськими хроматидами, сучасний метод аналізу якої запропонували в 1972 р А. Ф. Захаров і Н. А. Єголіна. При реплікації хромосом лімфоцитів периферичної крові людини в присутності 5-бромдезоксіурідіна (БДУ) цей аналог включається на місце тимідину. Якщо БДУ дають тільки протягом одного клітинного циклу, то міченої після другого циклу буде тільки одна хроматида з двох, якщо ж БДУ знаходиться в середовищі протягом двох клітинних циклів, то міченими до кінця другого циклу будуть обидві хроматиди (рис. 13.1): одна по обидва комплементарних ланцюгів ДНК, а інша тільки по одній. Виявити відмінність хро- матіди (що містять тимидин і БДУ) вдається тільки за допомогою барвників: азуреозіна, барвника Гімза, акридинового оранжевого і ін., А також при дослідженні флуоресценції хромосом з БДУ. Після забарвлення акридиновим помаранчевим хроматиди, що не містять брому, світяться в зеленій частині спектра, а включили бром - в червоній.
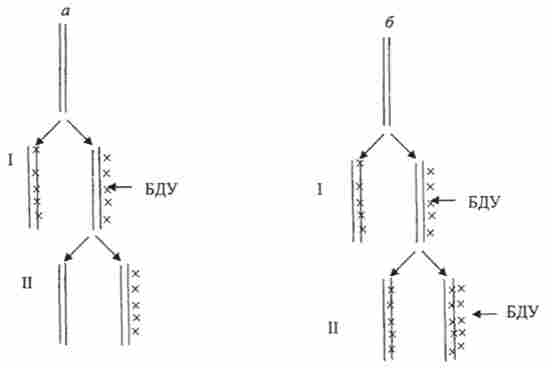
Мал. 13.1. Включення 5-бромдезоксіуріднна (БДУ) в ДНК в залежності від присутності БДУ протягом: а - одного ц ікла реплікації; б - двох циклів реплікації;
I- перша реплікація, II - друга реплікація
Збільшення частоти сестринських обмінів при дії будь-якого агента вказує на його генетичну активність (рис. 13.1).
У культурах клітин людини враховують також генні мутації, наприклад по локусу тимідинкінази. Цей експеримент займає від двох до п'яти тижнів. Час, необхідний для виявлення інших генетичних подій і у інших об'єктів, легко встановити, знаючи їх особливості. Експерименти з бактеріями при якісному або напівкількісному обліку генетичної активності займають одну тиждень. При кількісному дослідженні мутагенної активності із застосуванням системи метаболічної активації цей час збільшується до 4-5 тижнів. Подібні витрати часу необхідні для роботи з грибами: дріжджами і нейроспори. Порівнянні терміни потрібні для випробувань з використанням дрозофіли (2-7 тижнів) і вищих рослин.
Незважаючи на високу роздільну здатність всіх перерахованих тест-систем, найбільші можливості для екстраполяції отриманих результатів на людину представляють дослідження з ссавцями in vivo: з мишами, щурами, хом'яками. Це пов'язано зі специфікою дії мутагенів, з різними мутагенними ефектами на соматичних і генеративних клітинах, а також з відмінностями соматичних клітин in vitro і in vivo. Найбільш інформативні результати в тестах на мутагенез в специфічному локусе. Правда, при такому підході потрібна велика кількість тварин, отже, різко зростає вартість досліджень.
З урахуванням цих обставин постає проблема розробки не тільки чутливих тест-систем, яких з'являється все більше, але і системи тестів (Рис. 13.2). Багатьма дослідниками запропоновані різні варіанти східчастих систем тестування мутагенів і промутагенів, основу яких становить скринінг, або просіювання великого числа речовин на системах, що дозволяють швидко оцінити їх генетичну активність. Наступні етапи включають все менше число агентів, які досліджуються більш докладно.
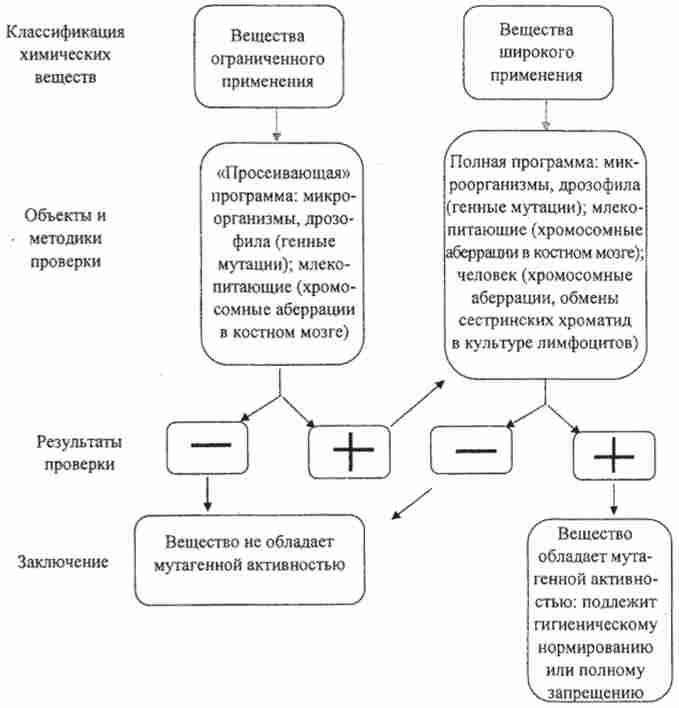
Мал. 13.2. Система тестування лікарських препаратів з метою виявлення їх генетичної активності
Велике значення для оцінки наслідків забруднення навколишнього середовища генетично активними факторами має спостереження за природними популяціями рослин, тварин і мікроорганізмів. Такий постійний контроль (моніторинг) змін генетичної структури природних популяцій дозволяє вловлювати зміни і прогнозувати їхні подальші наслідки. Крім того, в умовах забруднення багато з перерахованих систем можуть бути використані в якості чутливих біологічних дозиметрів мутагенної небезпеки, що особливо відноситься до культур мікроорганізмів з генетичними порушеннями систем репарації.