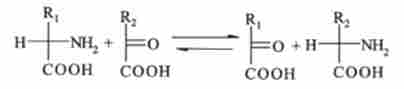
| Головна |
| «« | ЗМІСТ | »» |
|---|
Аналогічно відбувається утворення білка після травм і поранень в регенеріруемих тканинах.
Амінокислоти, що надходять в тканини організму, використовуються клітинами не тільки для біосинтезу білка. Вони включаються також в процеси енергозабезпечення життєдіяльності. Через ряд перетворень амінокислоти підключаються до циклу Кребса (рис. 9.7), і запасені в них енергія передається клітці.
Катаболізм амінокислот - основна частина азотистого обміну в організмі. Його шляху часто виявляються складними і довгими, з великим числом проміжних продуктів. Це пояснюється тим, що багато хто з проміжних продуктів виконують в клітці інші функції. Шляхи катаболізму амінокислот поліфункціонал ьни, т. Е. Переплітаються з іншими шляхами і дають початок численним відгалуженням.
У ссавців реакції розщеплення амінокислот протікають в основному в печінці. Активними в цьому відношенні є також нирки, а скелетні м'язи малоактивні.
Загальні шляхи перетворення амінокислот включають реакції дезаминирования, трансаминирования, декарбоксилирования і біосинтезу (див. вище).
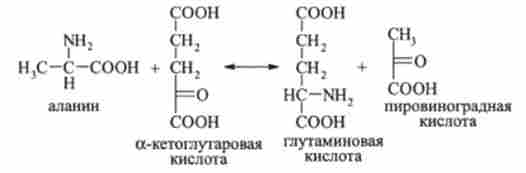
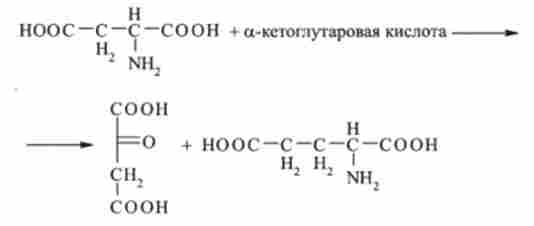
Під трансамінування амінокислот на увазі реакції міжмолекулярної перенесення аміногрупи -NH2 від амінокислоти на а-кетокислоту без проміжного освіти аміаку.
Теоретично реакції трансамінування можливі між будь-амінокислотою і кетокислот, однак найбільш інтенсивно вони протікають в тому випадку, коли один з реагентів представлений дикарбонової амінокислотою або кетокислот.
Мал. 9.7. Шляхи введення вуглецевих скелетів амінокислот в цикл Кребса
На певній стадії катаболізму щонайменше у 11 амінокислот (аланіну, аргініну, аспарагіну, аспарагінової кислоти, цистеїну, ізолейцину, лізину, фенілаланіну, триптофану, тирозину і валін) а-аминогруппа отщепляется в результаті ферментативної реакції трансамінування. При цьому а-аминогруппа амінокислоти переноситься до а-вуглецевого атома однієї з трьох а-кетокислот - піровиноградної, а-кетоглутаровой або щавелевоуксусной.
Загальний підсумок трансаминирования різних амінокислот полягає в тому, що всі їх аміногрупи збираються в загальний фонд у вигляді однієї амінокислоти (зазвичай у вигляді глутамінової):
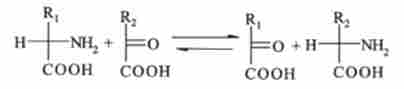
Відомі два найбільш важливих ферменту-трансамінази: аланінтрансамінази і глутаматтрансаміназа, каталізують реакцію перенесення аміногрупи -NH2.
Аланінтрансамінази каталізує реакцію
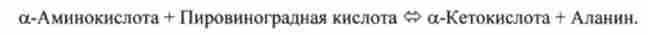
Глутаматтрансаміназа каталізує реакцію

В організмах, в яких домінуючою є аланінтрансамінази і а-аміногрупи всіх амінокислот, отже, накопичуються в формі аланина, відбувається в подальшому перенесення цих аминогрупп від аланіну до а-кето глутаровой кислоті, що каталізує ферментом аланінглутаматгрансаміназой.
Таким чином, незалежно від першої стадії трансаминирования кінцевим акцептором аміногруп більшості амінокислот є а-кетоглутарова кислота, яка перетворюється в глутамінової кислоти. Отже, глутамінова кислота служить передавачем аминогрупп в заключну ланцюг реакцій, що веде до утворення кінцевих продуктів азотистого обміну.
Все трансамінази містять один і той же кофермент - піридоксальфосфат. Для реакцій, що каталізуються їм, характерний загальний механізм.
Піридоксальфосфат діє в основному як переносник аминогрупп, а в деяких випадках і як переносник амінокислот. Безперервно переходячи з альдегідної форми в амінирована і назад, кофермент діє, таким чином, в якості переносника аминогрупп від амінокислоти до кетокислот.
Важливою стадією катаболізму амінокислот є дезамінування - відщеплення аміногрупи -NH ?. Доведено існування чотирьох типів дезаминирования амінокислот. У всіх випадках NH2-rpynna амінокислоти вивільняється у вигляді аміаку:
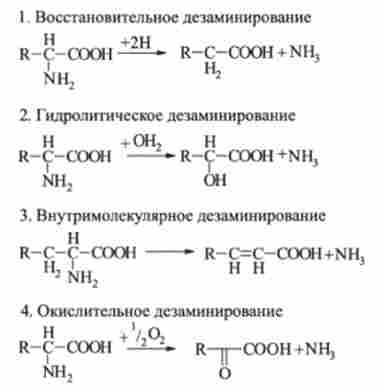
Найбільш поширена реакція окислювального дезамінування амінокислот.
Аміногрупи, перенесені з різних амінокислот, виявляються в кінцевому рахунку а-аминогруппами L-глутамінової кислоти:
Окислювальне дезамінування протікає в дві стадії:
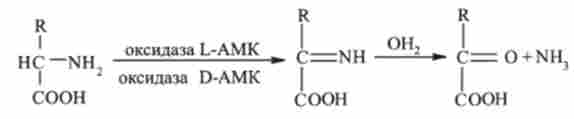
Перша стадія є ферментативної і завершується утворенням нестійкого проміжного продукту - імінокіслоти R-C (NH) -COOH. Імінокіс- лота на другій стадії спонтанно, без участі ферменту, розпадається на аміак і а-кетокислоту.
Окислювальне дезамінування каталізується НАД-залежної глутаматде- гидрогеназой або оксидазами ЦО-амінокислот.
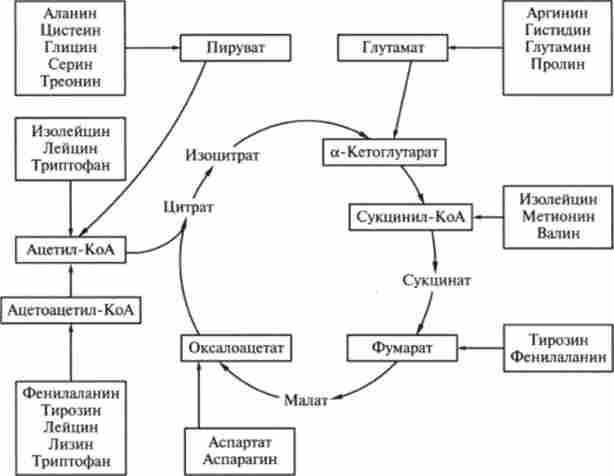
Шляхи катаболізму всіх 20 амінокислот можна розділити на кілька типів, в залежності від того, як ці амінокислоти вступають в цикл карбонових кислот (див. Рис. 9.6).
Включення продуктів розщеплення амінокислот в цикл трикарбонових кислот відбувається в основному через ацетил-КоА. Цим шляхом вступають в цикл 10 амінокислот, п'ять з них (цистин, треонін, гліцин, серин і аланін) проходять в цикл через стадію піровиноградної кислоти (пірувату):
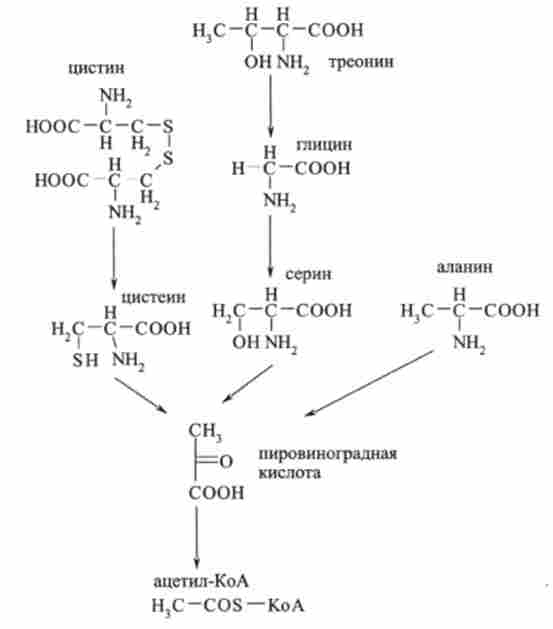
Ще п'ять амінокислот (фенілаланін, тирозин, лейцин, триптофан і лізин) проходять в цикл трикарбонових кислот через ацетоацетил-КоА:
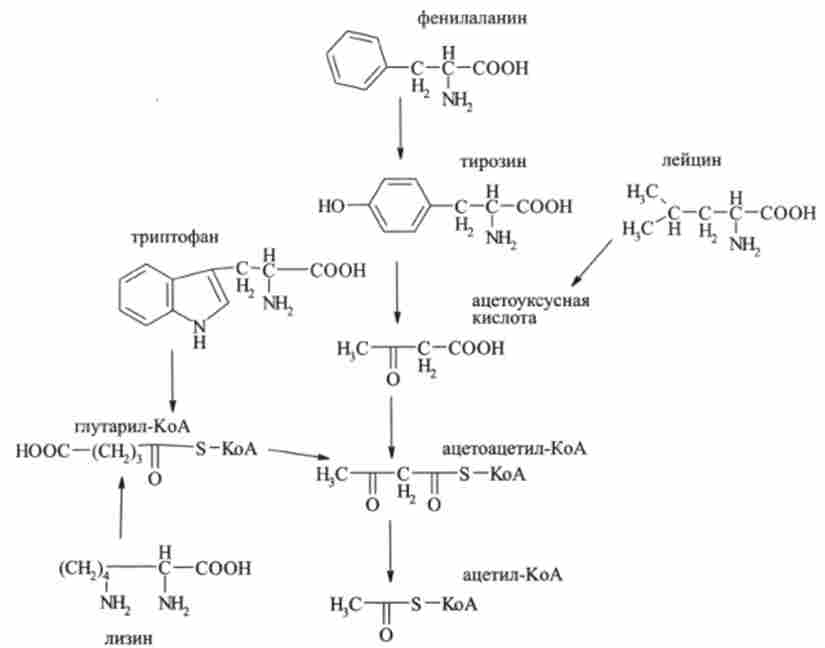
Вуглецеві скелети п'яти амінокислот (аргініну, гістидину, глутамінової кислоти, глутаміну і проліну) включаються в цикл трикарбонових кислот через а-кетоглутаровую кислоту, безпосереднім попередником якої є глутамінова кислота:
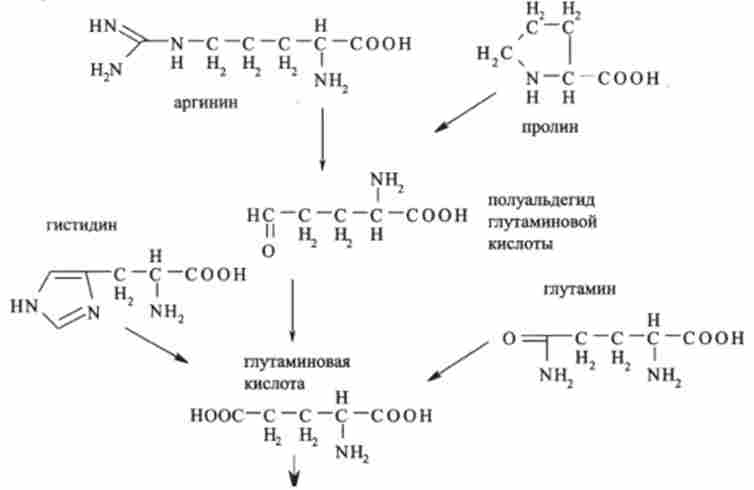
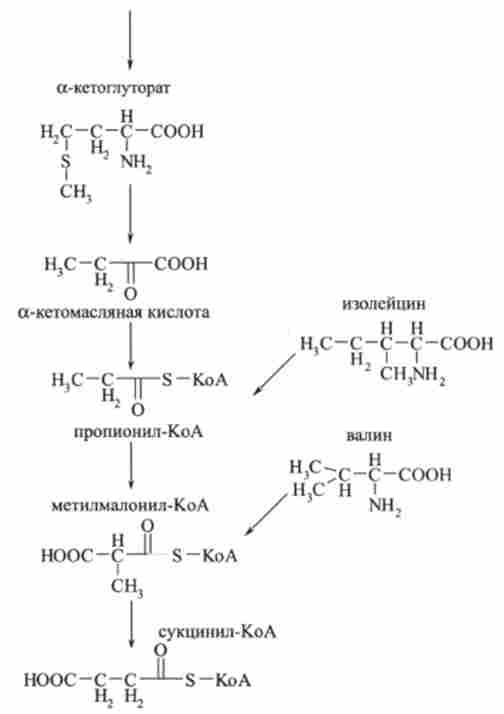
Розщеплення вуглецевих скелетів метіоніну, ізолейцину і валіну протікає через проміжне утворення пропіоніл-КоА і метил малої і л-КоА. Цей шлях приводить до утворення сукцинил-КоА і далі бурштинової кислоти, яка бере участь в циклі три карбонових кислот.
Аспарагин і аспарагінова кислота включаються в цикл трикарбонових кислот у формі солі щавелевоуксусной кислоти (оксалату). На першій стадії аспарагин гідролізується до аспарагінової кислоти і аміаку (фермент аспарагиназа):
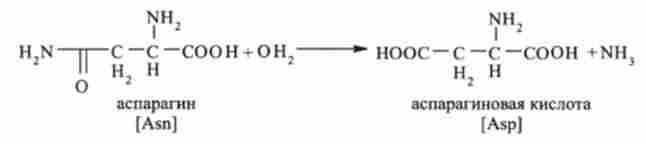
Аспарагінова кислота потім вступає в реакцію трансамйнірованія з а-кетоглутаровой кислотою. В результаті виходить щавелевоуксусная і глутамінова кислоти:
Продукт дезаминирования амінокислот аміак високотоксичний. Це обумовлено тим, що він бере участь в реакції відновного амінування а- кетоглутаровой кислоти в мітохондріях (фермент глутаматдегідрогеназа):
NH / + а-кетоглутаровую кислота + НАДН Про Глутаминовая кислота + НАД '.
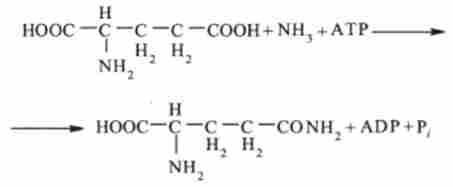
Оскільки рівновага цієї реакції сильно зміщений вправо, наявність аміаку сприяє видаленню а-кетоглутаровой кислоти з циклу трикарбонових кислот. При цьому пригнічується клітинне дихання. Крім того, утворюється надмірна кількість кетонових тіл з ацетил-КоА в печінці. Тому концентрація вільного аміаку строго регулюється. Аміак у тканинах зв'язується з утворенням нетоксичних сполук, легко виділяються з сечею.
Одним із шляхів зв'язування і знешкодження аміаку в організмі, зокрема в мозку, сітківці, нирках, печінці і м'язах, є біосинтез глутаміну (або аспарагина).
Оскільки глутамін і аспарагін з сечею виділяються в невеликій кількості, було висловлено припущення, що вони виконують швидше транспортну функцію перенесення аміаку в нетоксичної формі.
Сумарне рівняння синтезу глутаміну, катализируемого глутамінсінтетазу:
Механізм синтезу глутаміну в присутності глутамінсінтетази може бути представлений в наступному вигляді:
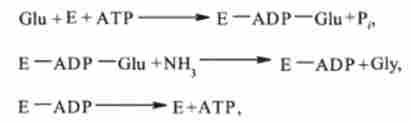
де Е - фермент глутамінсінтетаза.
Сумарна реакція відповідно запишеться у вигляді

У більшості наземних хребетних аміак зв'язується і виводиться у вигляді сечовини. Такі організми носять назву уреотелічних.
Тварини, що живуть у воді, наприклад кісткові риби, виділяють безпосередньо аміак; їх називають аммоміотелічними.
У птахів і наземних рептилій, які споживають обмежені кількості води, сеча являє собою напіврідку масу, яка містить кристали сечової кислоти; такі організми називаютьурікотелічними.
Основним механізмом знешкодження аміаку в організмі людини і наземних хребетних є біосинтез сечовини в орнітіновом циклі, званому також орнітінового циклом мочевінообразованія Кребса (відкритий в 1932 р).
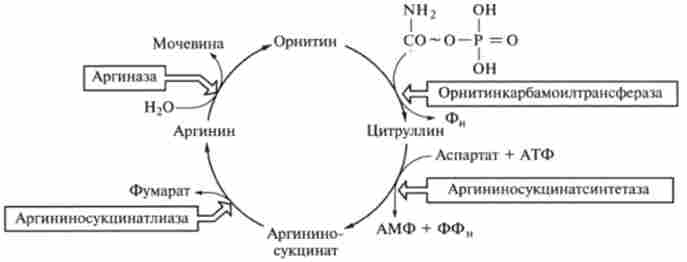
Мал. 9.8. I (ИКЛ мочевінообразованія
Цикл мочевінообразованія (рис. 9.8) може бути представлений таким чином.
На першій стадії синтезується макроергічних з'єднання карбамоілфосфат:
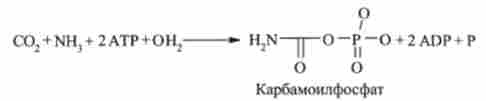
Реакція каталізується ферментом карбамоіяфосфатсінтетазой. Для освіти однієї молекули карбамоілфосфата в цій практично незворотною реакції потрібні дві молекули АТФ.
На другій стадії циклу відбувається конденсація карбамоілфосфата і орні- твань. В результаті цієї реакції, що каталізується ферментом орнітіітранскар- бамішзоі, виходять цитрулін і фосфорна кислота:
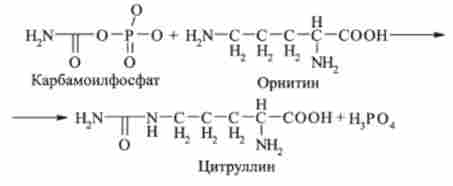
Другий аминогруппой, яка вступає в цикл сечовини, є аминогруппа аспарагінової кислоти, яка відбувається з глутамінової кислоти:

Аміногрупа аспарагінової кислоти конденсується потім з карбонільним атомом вуглецю молекули цитруллина в присутності АТР. В результаті виходить аргнніноянтарная кислота. Реакція каталізується ферментом аргініносук- цінатсінтетазой:
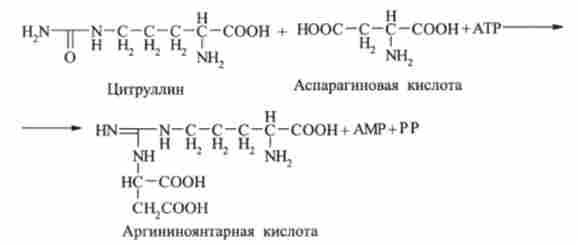
Далі аргініноянтарная кислота піддається ферментативному розщепленню з утворенням аргініну і вільної фумаровой кислоти:
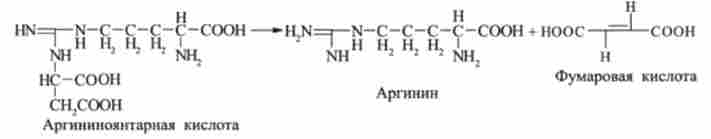
На останньому етапі аргінін розщеплюється на сечовину і орнітин під дією аргінази:
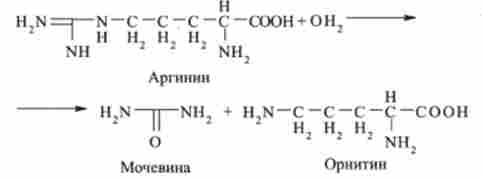
Далі орнітин реагує з карбамоілфосфат (див. Другу стадію) і цикл замикається.
Сумарна реакція синтезу сечовини без урахування проміжних продуктів:

Дана реакція супроводжується зниженням вільної енергії AG
Пирофосфат РР, в подальшому гідролізується до фосфату. Тому на освіту однієї молекули сечовини витрачається в цілому чотири високоенергетичні фосфатні зв'язку.
Аспекти азотистого обміну в відновної медицини
Одним з характерних порушень азотистого обміну є білкова недостатність - наслідок не тільки дефіциту білка, але і ряду захворювань навіть при достатньому надходженні білка з їжею.
Білкова недостатність у людини розвивається як при повному і частковому голодуванні, так і при прийомі одноманітного білкового харчування, коли в дієті переважають білки рослинного походження, біологічна цінність яких значно нижче цінності білків тваринного походження. Результатом є розвиток негативного азотистого балансу - гіпопротеі ньому і і (зниження концентрації білків в сироватці крові до 30-50 г / л при нормі 65-85 г / л). При цьому спостерігаються порушення колоїдно-осмотичного і водно-сольового обміну (розвиток «голодних» набряків).
Часто зустрічаються спадкові дефекти реабсорбції (всмоктування) амінокислот в нирках. В результаті амінокислоти йдуть з сироватки крові в сечу і розвивається гіпопротеїнемія. У медицині відома велика кількість вроджених порушень амінокислотного обміну (табл. 9.2)
Таблиця 9.2
Вроджені хвороби, пов'язані з порушеннями амінокислотного обміну
|
Болешь |
Порушене фермент або процес |
|
альбінізм |
тирозиназа |
|
Алкаптонурия |
Оксидаза гомогентізі нової кислоти |
|
Аргініносукцінатацідемія |
Аргініносукціназа |
|
I (істіноз |
Утилізація цистину |
|
цистинурия |
Обмін сірковмісних амінокислот цистину, лізину і аргініну |
|
синдром Фанконі |
Підвищене виділення амінокислот |
|
хвороба Гаршапа |
Тріптофанпірролаза |
|
Г істідінсмія |
Г істідаза |
|
гомоцистинурія |
Цістатіонінсінтетаза |
|
Ізовалсратацідсмія |
Ізовалсріл-КоА-дсгідрогсназа |
|
Лейііноз |
Ферменти, декарбоксилази розгалужених а-кетокислот |
|
Фснілкстонурія |
Фснілаланінгідроксілаза |
Одним з добре відомих захворювань вважається цистиноз. який іноді ототожнюється з синдромом Абдергальдена-Фанконі як за клінічними та біохімічними проявам, так і за характером спадкової передачі хвороби. Основний метаболічний дефект в обох випадках пов'язаний з вродженим порушенням реабсорбції майже всіх амінокислот. При цістінозе утворення каменів майже не відбувається на відміну від іншого вродженого порушення обміну - цістінуріі, при якій завжди утворюються цистинові камені. Сутність дефекту реабсорбції амінокислот при цістінозе не з'ясована.
Цистинурия відноситься до досить поширеним спадковим захворюванням. Метаболічний дефект виражається у виділенні з сечею в 50 разів більше норми чотирьох амінокислот: цистину, лізину, аргініну і орнитина. Рівень цистину в крові зазвичай не вище нормальних величин. Люди, які страждають цістіну- рией, цілком здорові за винятком тенденції до утворення в організмі каменів. Ця вроджена аномалія обміну пов'язана з повним блокуванням реабсорбції цистину і частковим порушенням всмоктування трьох інших амінокислот в нирках. Порушень в проміжному обміні даних амінокислот при цьому не виявлено.
При іншому спадковому пороці обміну - гепатоцеребральной дистрофії (хвороби Вільсона), крім загальної гіпераміноацідуріі, відзначається зниження концентрації медьсодержащего білка - церулоплазміну - в сироватці крові і відкладення міді в мозку, печінці, нирках. Можливо, що вільна мідь утворює комплекси з амінокислотами, які не всмоктуються в канальцях нирок.
Пильна увага вчених привертають деякі спадкові захворювання людини, що є результатом первинного дефекту обміну окремих амінокислот. Розвиток специфічного патологічного синдрому при цих захворюваннях обумовлено повним або частковим відсутністю деяких ферментів. Організм втрачає здатність синтезувати білок таких ферментів через недостатню кількість необхідних амінокислот.
Подібні спадкові захворювання викликають збільшення вмісту в тканинах нормальних проміжних або побічних (неспецифічних) продуктів обміну, які надають токсичний вплив на організм, і в першу чергу на центральну нервову систему.
Фен мул кетонах рія (фенилпировиноградная олігофренія) розвивається як результат втрати здатності організму синтезувати фенілаланін-4-монооксі- колагенази, каталізують перетворення фенілаланіну в тирозин.
Алкаптонурия характеризується екскрецією (виділенням) з сечею великої кількості (до 0.5 г / сут) гомогентизиновой кислоти, окислення якої киснем повітря надає сечі темне забарвлення.
Альбінізм виражається у природженому відсутності пігментів в шкірі, волоссі і сітківці. Метаболічний дефект пов'язаний з втратою меланоцитами здатності синтезувати тирозиназу - фермент, що каталізує окислення тирозину в ди- оксіфенілаланін і діоксіфенілаланінхінон, є попередниками меланіну.
Хвороба Гартнапа характеризується специфічними порушеннями обміну триптофану. Основним проявом хвороби, крім пеллагроподобних шкірних поразок, психічних розладів і атаксії, служить гіпераміноацідурія. Оскільки з сечею виділяються в підвищених кількостях індол мул ацетат, індолілаце- тілглутамін і индикан, але нормальні кількості індолілмолочной кислоти, то, очевидно, метаболічний блок пов'язаний з першою реакцією нормального шляху обміну триптофану і обмін переважно йде по шляху декарбоксилирования.
При іншому спадковому пороці обміну триптофану - хвороби «сеча із запахом кленового сиропу» і при фенілкетонурії також виводиться індол іл ацетат, але в цих випадках він має своїм джерелом індолілпіруват, так як паралельно з сечею виділяється у великих кількостях і ідол мул молочна кислота, яка може утворитися тільки з фенілпірувата.
Таким чином, первинні порушення обміну окремих амінокислот зазвичай наступають внаслідок блокування дії будь-якого ферменту.
* * *
У цьому розділі були розглянуті основні шляхи розщеплення білків, а також наведені основні реакції, що протікають при їх катаболизме. Показано, що крім пластичної ролі білки виконують унікальну каталітичну функцію, якої не наділені ні вуглеводи, ні жири, ні будь-які інші речовини органічної природи.
Білки і амінокислоти беруть безпосередню участь в біосинтезі ряду гормонів, що регулюють процеси обміну речовин в організмі.
Таким чином, саме білковий обмін координує, регулює і інтегрує різноманіття хімічних перетворень в цілісному живому організмі, підпорядковуючи його завданням збереження виду, забезпечуючи тим самим безперервність життя.
Характерною особливістю білкового обміну є його розгалуженість. В метаболізмі 20 амінокислот, що входять до складу білкових молекул, в організмі тварин бере участь кілька сотень проміжних продуктів, тісно пов'язаних з метаболітами обміну вуглеводів і ліпідів.
Число ферментів, які каталізують хімічні реакції розщеплення білків, також обчислюється сотнями. Якщо до цього додати, що блокування одного будь-якого специфічного шляху обміну навіть однієї амінокислоти може привести до появи абсолютно невідомих продуктів обміну, то стають зрозумілими труднощі інтерпретації даних про регуляції процесів азотистого обміну в нормі і особливо при патологіях. Зі сказаного випливає висновок, що білки і амінокислоти (зокрема їх катаболізм) грають виключно важливу роль в життєдіяльності живого організму.