| Головна |
| «« | ЗМІСТ | »» |
|---|
Ферменти - це біологічні каталізатори, речовини, що прискорюють перебіг біохімічних реакцій в організмі. Переважна більшість реакцій, що протікають в живих організмах, здійснюється за їх участю.
Термін «фермент» (від лат. «Fermentum» - закваска) запропонував на початку XVII ст. голландський учений Ван Гельмонт для речовин, що беруть участь в спиртовому бродінні. Друга назва ферментів - ензими - також пов'язано з дріжджовими клітинами (від грец. «єп» - в, всередині і «zyme» - закваска).
Лише в 1897 р пивовар Бухнер вперше виділив з дріжджів (у вигляді водного екстракту) набір ферментів, які каталізують розщеплення цукру в процесі бродіння. Тим самим було доведено, що виділені з клітки ферменти зберігають здатність функціонувати поза клітиною.
Білкова природа ферментів остаточно визнана тільки в 30-і рр. XX століття після робіт Джона Нортропа з співробітниками. Вони виділили в чистому вигляді ферменти шлункового соку пепсин і тріпепсін і встановили, що молекули цих ферментів відносяться до білків.
Однак навіть в даний час на багато питань, що стосуються ферментів, ще немає точної відповіді. Наприклад, чому молекули ферментів набагато більші молекул субстратів, на які вони діють? Яким чином амінокислоти, самі по собі не здатні прискорювати хімічні реакції, після з'єднання в специфічні послідовності створюють потужні каталітичні системи?
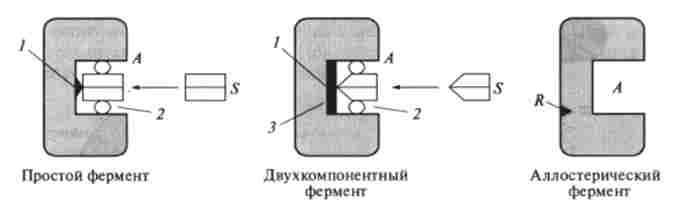
Всі ферменти складаються з власне білкових частин і пов'язаних з ними активних центрів (рис. 8.12). У молекулі ферменту розрізняють активний центр А, т. Е. Місце в просторову структуру ферменту, з яким зв'язується субстрат S, і білкову частина ферменту, яку називають апоферментом або апо- ензимом.
Селективність дії ферменту визначається Високовибірково здатністю субстрату дізнаватися його активний центр. Частина активного центру, відповідальну за селективне зв'язування, іноді називають адсорбційним центром ферменту, а ту частину, яка бере безпосередню участь в каталітичному процесі, називають катартичного центром. Ці два центри можуть перекриватися.

Мал. 8.12. Ферментні структури:
А - активний центр. S- субстрат, R - регуляторний, або аллостерічеський центр.
I - каталітичні ділянки. 2 - контактні ділянки. 3 - кофактор
В каталізі беруть участь наступні функціональні групи ферментів:
|
|
Наприклад, фермент панкреатична рибонуклеаза каталізує двустадийному гідроліз фосфодіефірних зв'язків в РНК, подібний в загальних рисах з лужним гідролізом цих зв'язків.
Білок, який в даному випадку сам по собі є ферментом і не вимагає участі додаткових кофакторів, «дізнається» специфічний субстрат, орієнтуючи його потрібним чином, і здійснює загальний кислотний і основний каталіз на двох стадіях гідролізу. Ці дві функції - найбільш загальні для всіх білків, які є ферментами або входять до їх складу.
Молекулярні маси ферментів лежать в межах від 12 000 до 1 000 000, що набагато перевищує молекулярні маси їх субстратів.
Ферменти діють тільки при прямому контакті з перетворюється субстратом, тому необхідною стадією процесу, що каталізує ферментом (ферментативного перетворення), є утворення комплексу ферменту з субстратом або субстратами.
Ферменти діють за принципом «ключ-замок», вирізи і виступи «борідки» ключа - субстрату - повинні відповідати замку - активного центру (рис. 8.13). Цим і визначається селективність дії ферментів.
Крім активного центру у ферментів є регуляторний (аллостерічеський) центр, який в молекулі ферменту просторово розділений з активним центром.
Речовини, що зв'язуються з аллостеричним центром, називають аллостерічного ефекторами, або позитивними (активатори), або негативними (інгібітори). Вони впливають через аллостерічеський центр на функцію активного центру.
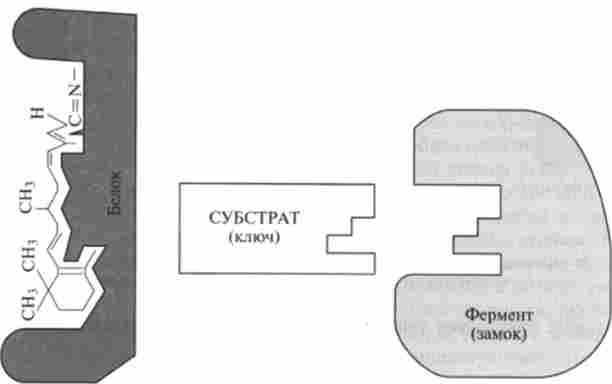
Мал. 8. 13. Дія активного центру ферменту за принципом «ключ-замок»
Зазвичай активний центр утворюють 12-16 амінокислотних залишків поліпептидного ланцюга. Амінокислоти, що формують активний центр, знаходяться в різних місцях поліпептидного ланцюга, нерідко на протилежних кінцях. При просторової укладанні вони зближуються і утворюють активний центр.
У простих ферментів роль функціональних груп контактного і каталітичного ділянок активного центру виконують тільки бічні радикали амінокислот. У складних ферментів головну роль в цих процесах відіграють кофактор.
Кофактор - молекула, поєднана з ферментом і активізує його роботу.
Характерною особливістю ферментів є їх специфічність.
Під специфічністю ферменту розуміється його властивість змінювати швидкість реакцій одного типу і не впливати на багато інших реакції, що протікають в
клітці.
Для каталітичної активності багатьох ферментів необхідний додатковий хімічний компонент - кофактор. Роль кофакторів грають неорганічні речовини, наприклад іони Fe3 Mn2 Zn, або складні органічні речовини, які в цьому випадку носять назви коферментів. Коферменти і іони металів зв'язуються з білком ферменту, іноді тимчасово і неміцно, а іноді - міцно і постійно. В останньому випадку небілкову частина ферменту називають простетіческоі групою.
У табл. 8.12 наведено список деяких ферментів, для яких необхідні іони або атоми металів в якості кофакторів.
Каталаза є типовим метаплоферментом, тому доцільно зупинитися докладніше на механізмі її дії.
Кисневе дихання призводить до утворення пероксиду водню Н2О2. Ця речовина має високу окислювальну здатність. Воно є побічним проміжним продуктом в процесі внутрішнього дихання клітин. При його взаємодії з біоорганічними сполуками клітин утворюються радикали дуже активні молекулярні частинки з ненасиченої валентністю - і ініціюється пероксидне окислення. Під дією радикалів руйнуються найважливіші складові частини клітини - мембрани і ДНК.
Таблиця 8.12
Ферменти з іонами або атомами металів
|
Fe2* Або Fe3* |
I іггохромоксідаза; каталаза; пе- роксідаза |
|
Сі2* |
11ітохромоксідаза |
|
'Г 2+ Zn |
ДНК-полімсраза; карбоан гід рази; алкогольдсгідрогспаза |
|
Mg2* |
Ге ксок і наза; г л юкоз-6-фосфатаза |
|
Mn2* |
аргіназа |
|
К * |
Піруваткіназа (спільно з Mg2+) |
|
Ni2* |
Урсаза |
|
Mo |
11ітратрсдуктаза |
|
Se |
I 'лутатіонпсроксідаза |
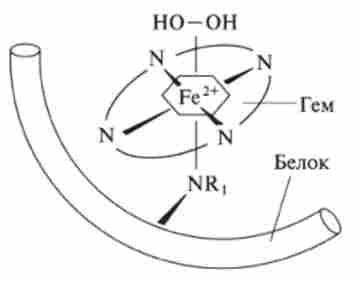
Мал. 8.14. Активний центр каталази CatFe2*
В ході біологічної еволюції природа виробила особливий білок - фермент каталазу, яка руйнує Н2О2. Тим самим обмежується надмірне накопичення цієї речовини і запобігає руйнування клітини.
За відсутності каталази пероксид водню розкладається повільно і накопичується в значних кількостях. Це призводить до негативних наслідків: Н202 взаємодіє з біоорганічними речовинами клітини, окисляє їх, що в кінцевому рахунку призводить до загибелі клітини. Це властивість пероксиду використовується для знищення патогенних мікроорганізмів при обробці свіжих ран.
До складу каталази, як і до складу більшості ферментів, входить іон металу. Тому такі біологічні каталізатори називаються металлоферментов. Хімічний аналіз показує, що в кожній молекулі каталази є іон заліза Fe2*. Цей факт не є несподіваним, оскільки вище було показано, що саме іони Fe2* Прискорюють розкладання Н202. Але суттєва відмінність полягає в тому, що в присутності каталази Н202 розкладається набагато швидше, ніж при такій же кількості солі заліза (II).
Будова активного центру каталази аналогічно такому гемоглобіну і міо глобіну (рис. 8.14).
Дія каталази CatFe2* Може бути представлено у вигляді каталітичного циклу з двох послідовних реакцій:
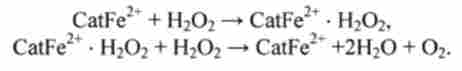
В результаті руйнуються дві молекули Н202, а молекула биокатализатора CatFe2* Звільняється і може вступати в наступний каталітичний цикл. Цей процес дуже швидкий. Протягом секунди 1 молекула каталази може здійснювати до 20 000 циклів.
Каталітична активність ферменту залежить від збереження нативної структури білка. Каталітична активність зникає при нагріванні білка в результаті теплової денатурації або при впливі денатурує агентами і розчинами з екстремальними значеннями pH.
Таким чином, для збереження каталітичної активності ферменту важливо збереження їх первинної, вторинної та третинної структур.
Дія більшості ферментів Високовибірково - специфічно. Поняття специфічності відноситься не тільки до типам каталітичних реакцій (реакційна специфічність), але і до природи сполук - субстратів (Субстратна специфічність).
розрізняють абсолютну, відносну (Групову) і стереохимичну специфічність.
Більшість ферментів володіє абсолютною специфічністю - прискорюють якусь одну реакцію. Прикладами абсолютної специфічності можуть служити: фермент сахароза (Інвертаза), що розщеплює тільки дисахарид сахарозу, мальтоза, діюча лише на мальтозу, лактаза - тільки на лактозу. Зазначені вище дисахариди - мальтоза, лактоза і сахароза - хоча і мають однакову емпіричну формулу С12Н22О11, але розщеплюються тільки під впливом трьох різних ферментів, так як розрізняються за структурою і складом входять до них моносахаридів.
Прикладом відносної (груповий) специфічності може служити дію ферменту пепсину. Дефіцит пепсину призводить до нетравлення шлунка. Цей фермент розщеплює самі різні білкові речовини їжі: білки м'яса, молока, рослин. У шлунку білкові речовини розщеплюються пепсином, незалежно від якості і кількості вхідних в них амінокислот, завдяки тому, що амінокислоти з'єднані пептидного зв'язком, яку і розщеплює пепсин (цей фермент розщеплює пептидні зв'язки між ароматичними амінокислотами). Отже, дія пепсину щодо специфічно.
Прикладом стереохимичної специфічності служать ферменти, що розщеплюють будь-якої ізомер а- або (5-цукрів. Сюди відносяться а- і р-глікозідази.
Активність ферментів залежить від кислотності (pH) середовища: одні ферменти здатні прискорювати хімічну реакцію, якщо середовище кисле, інші - якщо лужна, треті - якщо середовище нейтральна. Кожен фермент має оптимум pH, при якому він найбільш активний. Так, оптимум pH пепсину - 1,5-2,0, трипсину - 7,0 8,0, амілази - 6,8-7,2, ліпази - 7,0-7,5, тканинної протеази - 4,7-5,0.
Завдяки тому що кожен фермент проявляє свою дію при певному pH, в клітинах і тканинах організму можливе збереження суворої послідовності хімічних перетворень різних речовин.
Ферменти термолабільни. під термолабильностью ферментів розуміють їх нестійкість до високої температури. Инактивирование досліджуваного розчину при нагріванні до 100 ° С є одним з доказів того, що речовина, що міститься в розчині, є ферментом. Термолабильность обумовлена наявністю в молекулі ферменту білкової частини (апофермента. апоензіма).