| Головна |
| «« | ЗМІСТ | »» |
|---|
Білки поділяють на фібрилярні (міозин, колаген, кератин, фиброин шовку) і глобулярні (гемоглобін, ферменти, глобуліни крові).
Глобулярні (сферообразних) білки беруть участь в каталізі, транспорті, регуляції.
Фібрилярні (ниткоподібні) білки - структурні і силові. Вони складають основу нерозчинних у воді і міцних тканин, таких, як роги, копита, шерсть, волосся, шкіра, сухожилля.
Волосся - довгі міцні волокна, основою яких є білок а-кератин. Основа сухожиль інший білок - колаген. Еластичність і пружність стінок артерій або легеневих альвеол надає еластин.
Колаген утворюється поза клітинами з секретується ними білка - проколагену, який перетворюється в колаген в результаті взаємодії відповідних ферментів. Молекула колагену має вигляд потрійний суперспирали, утвореної трьома скрученими полипептидами. Приблизно третина амінокислотних залишків в коллагене представлена пролином, а кожен третій залишок - гліцином.
Гідроксилювання пролина вимагає в якості кофактора аскорбінову кислоту (вітамін С), яка потрібна для підтримки в відновленому стані іона Fe2 в активному центрі ферменту пролив-гідроксилази. При нестачі вітаміну С порушується утворення сполучних тканин, і це викликає цингу.
Три спірально навиті один на одного молекули колагену ковалентно пов'язані між собою, утворюючи міцну структуру. Додаткова стабілізація структури здійснюється водневими зв'язками гідроксильних залишків лізину і проліну.
Молекули колагену є ланцюг приблизно з 1000 амінокислот. Вони збираються в колагенові фібрили, стикуясь «голова до хвоста».
Порожнечі в цій структурі при необхідності можуть служити місцем початкового відкладення кристалів гідроксиапатиту Са5 (0Н) (Р04) З, що грає важливу роль в мінералізації кісток.
У сухожиллях колаген піддається ферментативної модифікації: в кінцевих частинах колагенових ланцюгів ковалентно зшиваються залишки лізину. Сухожилля є пучки паралельно орієнтованих фібрил. На відміну від сухожиль, колагенові фібрили шкіри утворюють подобу невпорядкованою сітки.
Еластин за своєю будовою відрізняється від колагену і а-кератину. Він містить звичайні а-спіралі. Еластин утворює мережу, висока еластичність якої обумовлена нековалентним зв'язуванням бічних ланцюгів лізину: чотирьох зближених лізі- нових залишків. В результаті в один вузол об'єднуються чотири пептидні ланцюга:

Більшість білкових молекул в організмі має Глобулярна будова. Пептидная ланцюг в глобулярних білках в природному стані згорнута в компактну структуру - глобулу, на відміну від фібрилярних білків, де довгі ланцюги витягнуті уздовж однієї осі.
Глобули стійкі у водних системах внаслідок того, що полярні групи основний і бічних ланцюгів зосереджені на поверхні в контакті з водою, а неполярні звернені в глиб молекули і захищені від цього контакту.
Термодинамічна стабільність згорнутої в глобулу молекули білка в водному середовищі невелика. Основною рушійною силою згортання ланцюга є ентропійний гідрофобний ефект, внаслідок якого неполярні групи прагнуть вийти з водного оточення і опинитися всередині глобули. Існує і зворотний ентропійний ефект, що перешкоджає згортанню. Він обумовлений тим, що у згорнутої молекули білка число дозволених конформаций основний і бічних ланцюгів менше, ніж у розгорнутій.
Гемоглобін нь - білок, який переносить кисень від легенів до тканин і здійснює транспорт вуглекислого газу від тканин назад до легенів. Нь локалізована в червоних кров'яних клітинах - еритроцитах.
Молекула нь складається з 4 підлогу і пептидних ланцюгів (з 2 ідентичних а- і 2 ідентичних p-ланцюгів), кожна з яких містить гемовую групу.
Функціональна взаємозв'язок 4 ланцюгів така, що приєднання О2 до одного з атомів заліза підвищує спорідненість до кисню у трьох інших залишків.
Поряд з нормальним гемоглобіном в організмі людини зустрічаються аномальні HbS, HbG, НЬС, НЬН. Спільність всіх гемоглобинов в способі укладання поліпептидних ланцюгів навколо великого плоского железосодержащего кільця гема, ідентичного для всіх.
Міоглобін - м'язовий білок, який переносить кисень в м'язових клітинах. Він складається з одного поліпептидного ланцюга, містить тільки а-спіралі, з'єднані петлями, і має один гем. Амінокислотна послідовність міоглобіну відрізняється від послідовностей як а-, так і (3-ланцюгів гемоглобіну. Однак
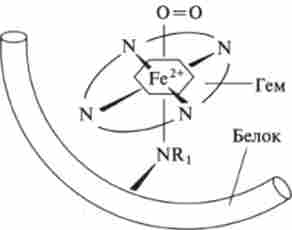
Мал. 8.11. молекула оксигемоглобина
третинна структура а- і (3-ланцюгів гемоглобіну і ланцюги міоглобіну ідентична.
Гем складається з атомів вуглецю, азоту і водню, що утворюють плоске кільце, зване порфіринів. У центрі кільця знаходиться атом Fe, пов'язаний з атомами кільця 4 координаційними зв'язками (з 6 можливих). До гему примикають 2 залишку гістидину (His). Імідазольна група гістидину пов'язана координаційної зв'язком з атомом Fe через 5-ю координаційну зв'язок. За 6-й зв'язку приєднується молекула кисню 0 = 0 (рис. 8.11).