| Головна |
| «« | ЗМІСТ | »» |
|---|
«У всіх рослинах і тваринах присутня речовина, яке, без сумніву, є найбільш важливим з усіх відомих речовин живої природи і без якого життя було б на нашій планеті неможлива. Ця речовина я найменовував "протеїн" »- так писав в 1838 р голландський біохімік Жерар Мюльдер. Він вперше відкрив існування в природі білкових тіл і сформулював свою теорію протеїну.
Слово «протеїн» походить від грецького слова «protos», що означає «Перший». І справді, все живе на землі містить білки. Вони складають близько 50% сухої маси тіла всіх організмів. У вірусів зміст білків коливається від 45 до 95%.
Білки є одним з чотирьох основних органічних речовин живої матерії (білки, нуклеїнові кислоти, вуглеводи, жири), але за своїм значенням і біологічним функціям вони займають особливе місце. Близько 30% всіх білків людського тіла знаходиться в м'язах, близько 20% - в кістках і сухожиллях і близько 10% - в шкірі.
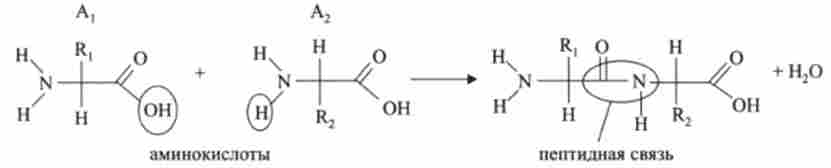
Білки утворяться в результаті послідовних реакцій конденсації амінокислот. Спочатку реагують дві амінокислоти (Ai і А2) І утворюється дипептид
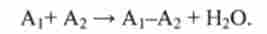
Наприклад.
Потім з дипептидом реагує ще одна амінокислота, утворюючи трипептид:
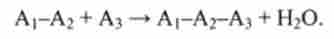
В результаті послідовного приєднання амінокислот утворюється поліпептид - полімерна молекула (див. гл. 2), мономерами якої є амінокислоти, з'єднані пептидними зв'язками (Звідси назва полімерів).
Число амінокислот (ступінь полімеризації) в поліпептиді може досягати декількох тисяч. У реакцію полімеризації можуть вступати 20 амінокислот (див. Табл. 8.8) в різних комбінаціях, тому число поліпептидів дуже велике. Але лише деякі з них відносяться до білків.
Білки - це поліпептиди, які були відібрані в ході біологічної еволюції і увійшли до складу різних живих організмів.
У кожній клітині людини функціонують тисячі молекул різних білків. З точки зору хімічної будови між поліпептидами і білками відмінності немає. Білки - поліпептиди, створені кліткою. Вони унікальні.
Білки можуть складатися з декількох полнпептідний ланцюгів. Пептидні ланцюги в такому білку можуть бути пов'язані як слабкими молекулярними зв'язками, так і міцними ковалентними непептідние зв'язками.
Друга назва білків - «протеїни» - говорить про найважливішу роль білків в життєдіяльності організму. Їх основні функції - каталітична і структурно-силова. Білки-біокатапізатори називаються ферментами. Основна маса структурно-силових білків знаходиться в м'язових тканинах.
Білки розрізняються: 1) за якісним складом (складаються з різних амінокислот); 2) по молярніймасі (різне число амінокислот в молекулі); 3) по порядку з'єднання амінокислот в ланцюзі (табл. 8.10). Порядок розташування амінокислот в поліпептиди називають амінокислотною послідовністю. Процедуру встановлення цієї послідовності називають секвенуванням (Від англ, «sequence» - послідовність). Секвенування грає важливу роль у вивченні хімії білка.
Наприклад, протомін молока і білок лососевих риб сальмін містять 81% Arg, 9% Ser, 10% припадає на інші амінокислоти.
Перший поліпептид, амінокислотна послідовність якого була встановлена, - інсулін, який грає важливу роль в регулюванні рівня глюкози в крові. На рис. 8.7 амінокислотна послідовність цього низькомолекулярного білка позначена ланцюгом з трибуквених або однобуквених символів відповідних амінокислот.
Таблиця N. 10
Зміст (травні. Частка,% або г / 100 г) амінокислот в білках
|
амінокислота |
Міоген. юбін (М'язи) |
гемоглобін (Зрітроціти) |
Альбумін (яєчний білок) |
|
аланин |
5,7 |
9.0 |
6.7 |
|
гліцин |
6,3 |
4,2 |
3,1 |
|
валін |
5,3 |
10,3 |
7.1 |
|
лейцин |
I2.2 |
14,0 |
9.2 |
|
ізолейцин |
5,0 |
0 |
7.0 |
|
11ролик |
4.6 |
4.8 |
3.6 |
|
фенілаланін |
6,2 |
7,3 |
7,7 |
|
тирозин |
2,4 |
2,9 |
3,7 |
|
треонін |
3,6 |
1,9 |
4,0 |
|
Серін |
4,6 |
4,4 |
8,2 |
|
триптофан |
2.9 |
5,2 |
3,7 |
|
цистеїн |
1 |
1 |
1,9 |
|
метіонін |
2.5 |
1,2 |
5,2 |
|
аргінін |
2.7 |
3,3 |
5.7 |
|
гістидин |
8.2 |
8,8 |
2.4 |
|
лізин |
16,1 |
9,6 |
6,3 |
|
аспарагин |
9,2 |
9,6 |
9.3 |
|
глутамин |
17,3 |
6,0 |
16.5 |
Іонізовані групи в бічних ланцюгах поліпептиду обумовлюють Електролітну природу білків. Частка іонізованих кінцевих груп поліпептід- ної ланцюга надзвичайно мала. Ступінь іонізації бічних груп залежить від pH середовища.

Мал. 8.7. Амінокислотна послідовність низькомолекулярного білка інсуліну
Ізоелектричної точкою білка (ВЕТ) називається значення pH, при якому білкова молекула має однакове число позитивних і негативних іонізованих груп (заряд молекули дорівнює нулю).
Кожному білку властиво своє значення ізоелектричної точки (табл. 8.11). ВЕТ білків характеризується тим, що при такому pH середовища розчинність білка мінімальна і молекула білка залишається нерухомою в постійному електричному полі.
Таблиця 8.11
Значення pi = pH Ізоелектрична точок для деяких білків
|
білок |
Молярна маса, г / моль |
Pi (ВЕТ) |
|
міоглобін кашалота |
17 600 |
7,0 |
|
пепсин |
35 000 |
1,1 |
|
альбумін яйця |
40 000 |
4.6 |
|
гемоглобін коні |
: 68 000 |
6.6 |
|
Урсаза сечі тварин |
483 000 |
4.9 |
|
Дт-іпневмококковий білок коні |
660 000 |
4,7 |
При додаванні кислоти знижується pH середовища і білок внаслідок придушення дисоціації карбоксильних груп переходить в форму катіона, при додаванні лугу підвищується pH - заряд білкової молекули змінюється на негативний і молекула білка переходить в форму аніону. На основі цього білки відносять до поліамфоліта. Дана властивість білків використовують для їх аналізу методом електрофорезу (див. Гл. 3).
Амінокислотна послідовність в розгорнутій конформації молекули визначає первинну структуру білка (рис. 8.7).
Первинна структура білка - порядок з'єднання амінокислот в макромолекулу (амінокислотна послідовність). Ця послідовність відтворюється в процесі біосинтезу. Кожен індивідуальний білок володіє строгим постійністю складу і первинною структурою. Зміни в первинну структуру білка ведуть до порушення його функцій в процесі обміну речовин.
Кінцевий ділянку ланцюга, на якому знаходиться ІГЬ-група, називають N-кінцевим, а протилежний ділянку з СООН-групою - С-кінцевим. Основну ланцюг без амінокислотних радикалів називають поліпептидним скелетом молекули, радикали R - бічними ланцюгами.
На ранніх стадіях вивчення білків про величину і форму білкових молекул судили за даними ультрацентрифугирования, подвійного променезаломлення і дифузії. Ці дані вказували на існування глобулярних (кулястих) і фібрилярних (ниткоподібних) білків.
В даний час ці уявлення про форму білкових молекул в основному підтвердилися. Однак тільки сучасні методи дослідження дозволили встановити деталі просторової конфігурації (тривимірної структури) білкових молекул.
За допомогою скануючої мікроскопії та рентгеноструктурного аналізу (висока роздільна здатність, порядку 0,2-0,3 нм) вдалося в деталях розшифрувати не тільки повну просторову структуру, форму, але і ступінь асиметрії білкових молекул у всіх трьох вимірах. Виявилося, що навіть глобулярні білки крові (гемоглобін, альбумін і глобуліни) асиметричні.
Особливо важливо, що не тільки фізико-хімічні, а й біологічні властивості білків як у вільному, так і в зв'язаному з іншими биополимерами стані визначаються їх просторової структурою.
Розгорнута конформація молекули білка нестійка, і в результаті теплового руху первинна структура білка переходить у вторинні структури - а-спіраль, p-шари (складки), безладний клубок (coil-ділянки) і потім в третинні структури (рис. 8.8). В результаті молекули білка набувають різні форми - конформації.
під вторинної структурою білка мають на увазі спосіб згортання, скручування (складання, упаковка) поліпептидного ланцюга в спіральну або яку-небудь іншу конформацію. Процес цей протікає не хаотично, а відповідно до програми, закладеної в первинній структурі. а-Спіралі і р-шари - найбільш вивчені конфігурації поліпептидних ланцюгів.
Завдяки дослідженням Л. Полінга а-спіраль прийнято вважати найбільш імовірним типом будови глобулярних білків. Закручування поліпептидного ланцюга відбувається за годинниковою стрілкою (правий хід спіралі), що обумовлено амінокислотним складом природних білків. Рушійною силою у виникненні а-спіралей і P-шарів є здатність амінокислот до утворення водневих зв'язків.
На кожен виток (крок) а-спіралі доводиться 3,6 амінокислотного залишку. Крок спіралі (відстань уздовж осі) дорівнює 0,54 нм на виток, а на один амінокислотний залишок припадає 0,15 нм. Кут підйому спіралі 26 °, через 5 витків спіралі (18 амінокислотних залишків) структурна конфігурація поліпептидного ланцюга повторюється. Це означає, що період повторюваності (або ідентичності) спіральної структури становить 2,7 нм.
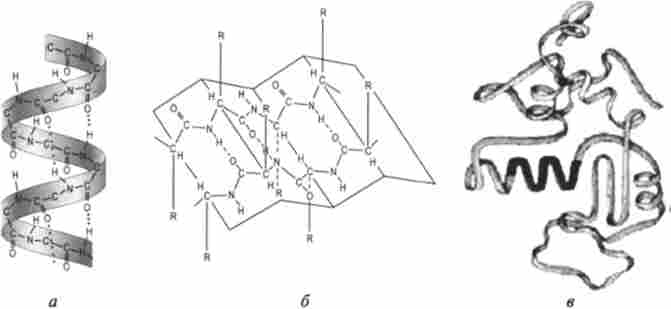
Мал. 8.8. Структури білка:
а - вторинна структура - а-спіраль, б - вторинна структура - P-шари (складки); в - третинна структура
Для кожного білка характерна певна ступінь спирализации його поліпептидного ланцюга.
Стійкість конформаций вторинних структур молекули білка забезпечується в основному водневими зв'язками між різними ділянками молекули.
Воднева зв'язок обумовлена електростатичним притяганням між одним електронегативним атомом (наприклад, киснем або азотом) і водневим атомом, ковалентно пов'язаних з другим електронегативним атомом (див. Гл. I).
Водневі зв'язки мають малу міцність. Для розриву хімічних міжатомних зв'язків необхідно затратити від 84 до 8400 кДж / моль, а для розриву однієї водневої зв'язку всього лише 6,3 кДж / моль. Але в білкової молекулі число водневих зв'язків дуже велике (в освіту водневих зв'язків залучені всі пептидні групи), і в сумі вони, забезпечуючи скручування поліпептидного ланцюга в спіральну структуру, повідомляють їй компактність і стабільність.
Третинна структура білка утворюється в результаті впорядкованого укладання а-спіралей і P-шарів. Прикладами є ниткоподібна (фібрилярна) і сферична (глобулярна) третинні структури білка.
Четвертичная структура білка утворюється в результаті впорядкованого укладання теоретичних структур - глобул або фібрил - кількох білкових молекул. Прикладами є м'язові білки - міозин, колаген (фібрилярна структура) і білок крові - гемоглобін (глобулярна структура) (рис. 8.9).
Четвертичная структура - надмолекулярну, мультімерной освіту взаємодіючих між собою білкових молекул - субодиниць. Четвертичная структура передбачає комплементарна взаємодія білкових молекул за рахунок водневих зв'язків. Ці комплекси з білкових молекул мають постійний склад і число субодиниць (рис. 8.9).
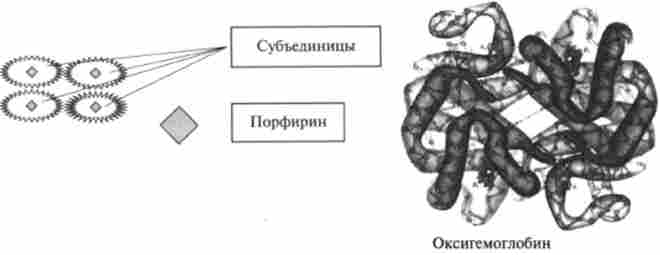
Мал. 8.9. Четвертичная структура гемоглобіну
Структура білків може зазнавати зміни (денатурацію) при зовнішніх впливах (рис. 8.10). Наприклад, всім добре відомо згортання курячого білка альбуміну при варінні яйця і молочного білка казеїну при закисании молока.
У загальному випадку денатурацією називають порушення структури нативної молекули білка, переважно її третинної структури, що приводить до втрати характерних властивостей {розчинність, електрофоретичної рухливість, біологічна активність).
Більшість білків денатуруючих при нагріванні їх розчинів вище 50- 60 ° С. Зовнішні прояви денатурації зводяться до втрати розчинності, особливо в ізоелектричної точці, підвищення в'язкості білкових розчинів, збільшенню кількості вільних функціональних SH-груп і зміни характеру розсіювання рентгенівських променів. Найхарактернішою ознакою денатурації є різке зниження або повна втрата білком його біологічної активності (каталітичної, антигенної або гормональної).
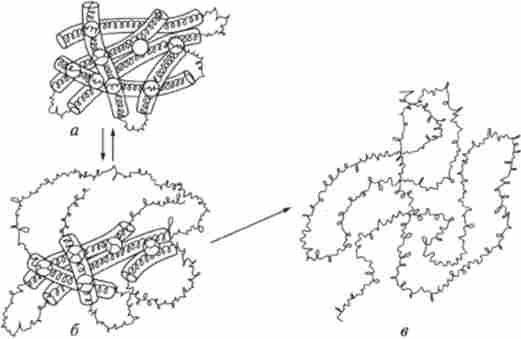
Мал. 8. W. Денатурація білкової молекули:
а - вихідна структура. 6 - частково денатурована структура, в - повністю денатурована структура