| Головна |
| «« | ЗМІСТ | »» |
|---|
Білки є структурними і силовими елементами, функціонують в якості каталізаторів (ферментів), а також «реалізаторів» дії генів. Середня масова частка білків в організмі людини становить 15% або 10,7 кг (див. Рис. 8.1). Це головним чином різні м'язи.
Білки належать до класу високомолекулярних сполук - полімерів (див. Гл. 2). Фізичні та хімічні властивості полімерів визначаються властивостями мономерів, з яких складається полімерна ланцюг. Тому перед розглядом білків необхідно вивчити властивості амінокислот - мономерів, з яких складаються полімерні ланцюги білків.
Перша амінокислота - гліцин - виділена А. Браконно в 1820 р з продуктів кислотного гідролізу білка. Однак повністю амінокислотний склад білків був визначений лише 100 років потому, до 30-их рр. XX ст.
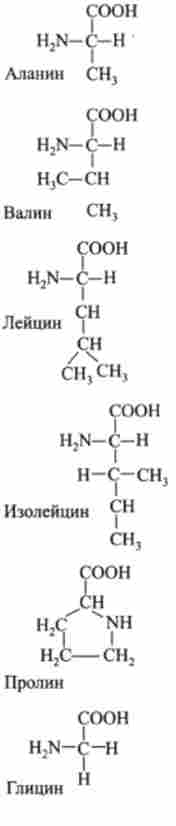
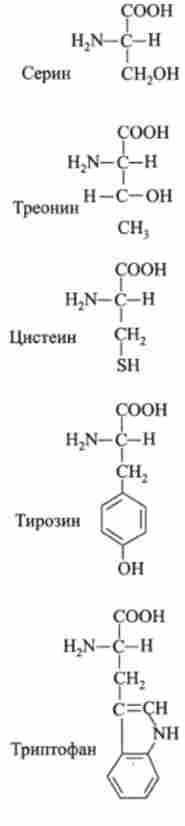
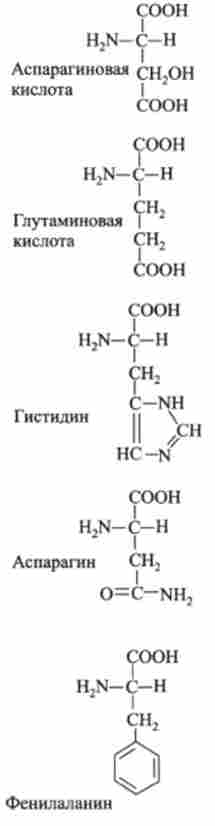
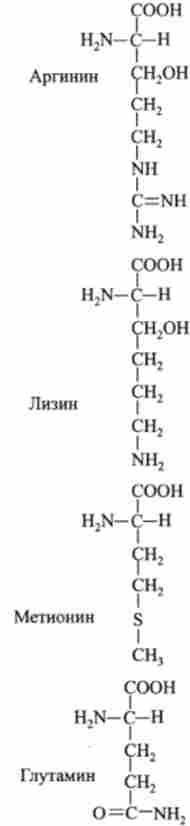
Встановлено, що при гідролізі чистих білків, які містять домішок, звільняються 20 різних а-амінокислот (табл. 8.8). Всі інші відкриті в тканинах тварин, рослин і мікроорга анізм амінокислоти (більше 300) існують в природі у вільному стані або у вигляді коротких пептидів або комплексів з іншими органічними речовинами.
Амінокислоти являють собою гомологічний ряд (див. Гл. 2) сполук загальної формули
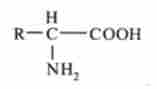
де R - радикал, що визначає індивідуальність амінокислоти.
Амінокислоти є амінокарбонових кислотами - похідними карбонових кислот, у яких один водневий атом при вуглеці заміщений на аміногрупу (-NH2). Прикладом може служити аланин СЬЬ -CH (NH2)-COOH.
Свою назву амінокислоти отримали по двом функціональним групам, що входять до складу молекули: аминной -NH2 і кислотної - СООН. Слід підкреслити, що всі амінокислоти, що входять до складу природних білків, є а-амінокислотами, хоча аминогруппа в вільних амінокарбонових кислотах може перебувати в р-, у-, 6 і е-положеннях (див. Нижче).
Класифікація амінокислот заснована на хімічному будову радикалів R (R-груп). Розрізняють ароматичні і аліфатичні амінокислоти, а також амінокислоти, що містять сірку або гідроксильні групи. У сучасній класифікації амінокислот (табл. 8.9) враховують полярність радикалів R, т. Е. Здатність до взаємодії з водою при фізіологічних значеннях pH 7,0.
Розрізняють 5 класів амінокислот:
У представленій класифікації амінокислот (табл. 8.9) наведено найменування, скорочені латинські і російські символи, значення ізоелектричної точки (pi).
Крім 20 основних амінокислот, в деяких білках виявлені оксіпро- лин, оксілізін, дийодтирозин, фосфосерин і фосфотреонин:
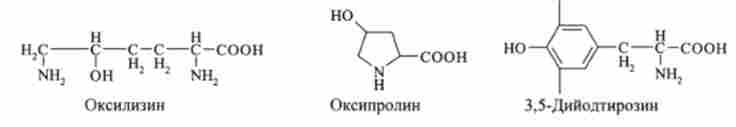
Перші дві амінокислоти містяться в білку сполучної тканини - коллагене. Дийодтирозин - основа гормонів щитовидної залози.
Таблиця 8.8
20 амінокислот - будівельних блоків білків
|
|
|
|
класи амінокислот
Таблиця 8.9
|
амінокислота |
скорочені обо1наченіі |
Ізозлекгрн- чна точка |
Травні. частка в білках,% |
|
|
лат. |
pyc. |
Pi |
||
|
I. Неполярні R-групи Глицин |
Gly |
гли |
5,97 |
7,5 |
|
аланин |
Ala |
Ала |
6,02 |
9,0 |
|
валін |
Val |
Вал |
5,97 |
6,9 |
|
лейцин |
l.eu |
лей |
5,97 |
7,5 |
|
Ізолсйцін |
lie |
Ілі |
5,97 |
4,6 |
|
пролин |
Pro |
про |
6,10 |
4,6 |
|
амінокислота |
(пофарбовані позначення |
Ізозлектрн- чна гочка |
Травні. толя в білках,% |
|
|
лат. |
PVC. |
Pi |
||
|
II. Полярні, незаряджені R-групи |
||||
|
Серін |
Ser |
Cep |
5.68 |
7,1 |
|
треонін |
Thr |
Tpc |
6.53 |
6.0 |
|
I Цистеин |
Cys |
цис |
5.02 |
2.8 |
|
метіонін |
Met |
мет |
5.75 |
1.7 |
|
аспарагин |
Asn |
Ach |
5.41 |
4.4 |
|
глутамин |
Gin |
Глн |
5.65 |
3,9 |
|
111. Ароматичні R-групи |
||||
|
фенілаланін |
Phe |
фен |
5.98 |
3.5 |
|
тирозин |
Tyr |
тир |
5,65 |
3.5 |
|
триптофан |
Trp |
Три |
5,88 |
1.1 |
|
IV. Негативно заряджені R-групи |
||||
|
аспарагінова кислота |
Asp |
асп |
2,97 |
5.5 |
|
глутамінова кислота |
Glu |
гли |
3.22 |
6.2 |
|
V. Позитивно заряджені R-фупп |
||||
|
лізин |
Lys |
Ліз |
9.74 |
7,0 |
|
аргінін |
Arg |
Apr |
10,76 |
4.7 |
У м'язовому білку міозину виявлено N-метіллізін. До складу протромбіну (білок згортання крові) входить у-карбоксіглутаміновая кислота. Селеноцісте- ін, в якому ВІН-група серину замінена на селен Se, міститься в глутатіонпе- роксідазе:
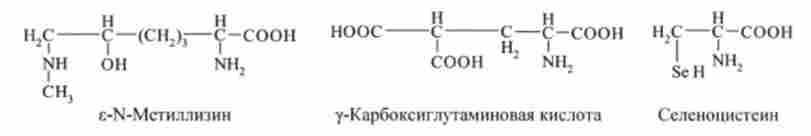
Ряд амінокислот виконує важливі функції в обміні речовин, хоча і не входить до складу білків. До них відносяться орнітин, цитрулін, гомосерін, гомоцистеїн, цістеінсульфіновая кислота, диоксифенилаланин.
Кислотно-основні властивості амінокислот визначають багато физикохимичні і біологічні властивості білків. На цих властивостях засновані методи виділення та ідентифікації амінокислот.
Амінокислоти добре розчинні у воді. Всі амінокислоти при фізіологічних значеннях pH переходять в форму біполярного іона - цвіттеріонов NH3CH (CH3) COO:
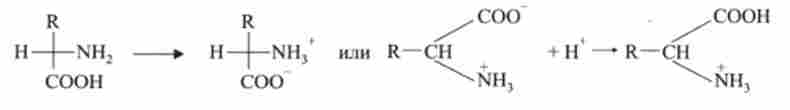
У водних розчинах амінокислоти, будучи амфоліти, можуть диссоциировать як кислота (донор протона) або як підставу (акцептор протона). Наприклад, аланін:
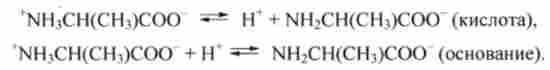
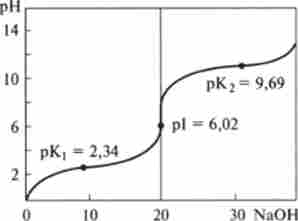
Мал. 8.6. Крива титрування водного розчину аланіну лугом
Якщо радикали амінокислот нейтральні, то вони обливають незначне впливу на дисоціацію карбокси- і аминогрупп. Тому константи дисоціації До і кг практично однакові для різних амінокислот. Внаслідок цього криві титрування нейтральних амінокислот подібні.
Як приклад на рис. 8.6 приведена крива титрування аланина.
Якщо до водного розчину аланіну (наприклад, 0,1 М) поступово додавати луг (0.1 М розчин NaOH), отримують криву титрування, типову для всіх нейтральних амінокислот (рис. 8.6).
значення рК для карбоксильної групи і РКГ для аміногрупи (вони дорівнюють значенням pH розчину, при яких ці групи наполовину диссоційовані) істотно розрізняються: рК = 2,34, рК-> - 9,69. При низьких значеннях pH <рК майже всі молекули аланіну повністю протоновану і несуть позитивний заряд.
З кривої титрування видно, що точка переходу між гілками кривої знаходиться в області pH 6,02. При цьому сумарний (або середній) електричний заряд молекули аланіну дорівнює нулю. Таке значення pH називають ізоелектричної точкою і позначають pi. У цій точці молекули амінокислот не переміщаються в електричному полі ні до анода, ні до катода (Ізоелектрична стан).
Ізоелектрична точка амінокислот, що не містять додаткових Nfy- або СООН-груп. дорівнює среднеарифметичному значенням рК
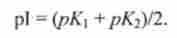
Для аланина pi = (2,34 + 9,69) / 2 = 6,02.
Важливою властивістю амінокислот є їх оптична активність.
У водних розчинах амінокислот спостерігається обертання площини поляризації світла (виняток становить гліцин). Ця властивість пов'язана з наявністю асиметричного атома вуглецю (т. Е. Атома, всі чотири валентні зв'язки якого зайняті різними заступниками) в a-положенні молекули.
Стереоізомерія амінокислот визначається виходячи з абсолютної конфігурації чотирьох заміщають груп, розташованих навколо асиметричного атома вуглецю в вершинах моделі тетраедра. Стереоізомерами амінокислот прийнято співвідносити з гліцериновим альдегідом, також містить асиметричний атом вуглецю.
Нижче представлені L- і D-стереоізомери гліцеринового альдегіду. Поруч показані просторові конфігурації L- і D-аланіну:
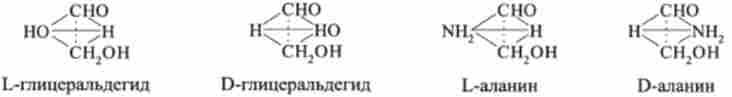
Вага амінокислоти, які утворюються при гідролізі природних білків в умовах, що виключають рацемізації, належать до L-ряду. Таким чином, природні амінокислоти мають просторове розташування, аналогічне конфігурації L-гліцеринового альдегіду.
Символи L і D в назві означають приналежність даної амінокислоти по стереохимичної конфігурації до L- або D-ряду, знак «+» або «-» вказує на напрямок обертання площини поляризації світлового променя.
Для якісного і кількісного визначення амінокислот в біооб'єктах застосовується реакція з нингидрином. На I стадії реакції утворюється відновлений нингидрин:
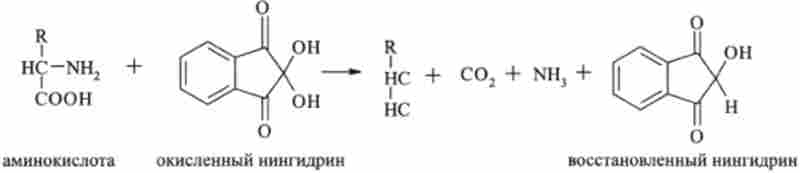
На II стадії аміак NH3 реагує з окисленої і відновленої формою нингидрина. При цьому утворюється продукт синьо-фіолетового кольору:
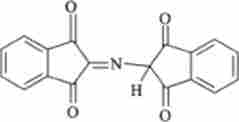
Кількість цього продукту і відповідно амінокислоти визначають спектрофотометричним методом на довжині хвилі 570 нм.
Нінгідринова реакція завдяки своїй високій чутливості використовується в сучасних автоматичних аналізаторах амінокислот.