
| Головна |
| «« | ЗМІСТ | »» |
|---|
Розробка сучасної моделі атома і передбачення на її основі властивостей індивідуальних атомів - дуже важливе досягнення квантової механіки. Однак в земних умовах рідко зустрічаються ізольовані атоми. Навколишні нас тіла неживої і живої природи побудовані з молекул.
молекули - найменші частинки речовини, які складаються з двох і більше атомів і визначають хімічні властивості речовини.
Основне завдання квантової механіки - розшифровка електронної будови молекул і прогнозування їх властивостей.
Живі організми побудовані з самих різних молекул. Це і численні низькомолекулярні сполуки - амінокислоти, цукру, жири, неорганічні речовини, і високомолекулярні сполуки - дуже складні молекули білків, нуклеїнових кислот, що становлять основу життя.
Хіміків завжди цікавили питання: чому одні атоми з'єднуються в молекули, а інші ні? Чому одні речовини стійкі, а інші швидко розпадаються? Чому все молекули навіть самого складного речовини однакові? Відповіді на ці питання важливо знати і біологам і медикам. Наприклад, ідентичність всіх молекул ДНК (дезоксирибонуклеїнова кислота) в організмі тварини - необхідна умова стійкості спадкових властивостей і причина генетичних хвороб.
На багато з цих питань відповів видатний російський хімік А. М. Бутлеров (1828-1886), який створив теорію хімічної будови органічних речовин (1861). З цього часу в хімію починають поступово входити поняття «валентність» і «хімічний зв'язок».
Валентністю називають здатність атома приєднувати певне число інших атомів з утворенням молекули. Валентність позначають рисками у символу елемента. Водень (Н) - одновалентних, кисень (0 =) - двовалентний. Число валентних рисок визначає число хімічних зв'язків, які даний атом може утворити з іншими атомами. Так, один атом кисню з'єднується з двома атомами водню, утворюючи воду Н-О-Н. При з'єднанні атома
н /н
вуглецю з чотирма атомами водню виходить метан УСС , а з двома ато-
W хн
мами кисню - діоксид вуглецю 0 = С = 0. Уявлення про валентності і хімічного зв'язку, розроблені в XIX в., Широко використовують до теперішнього часу.
Однак класична теорія валентності носить емпіричний характер. Незрозуміло, наприклад, чому валентність кисню дорівнює двом, а водню - одиниці. Чому не утворюються молекули гелію? Чому валентність атомів може бути змінної? Природа хімічного зв'язку була встановлена лише після відкриття законів квантової механіки і розрахунку атомних орбіталей. Тільки тоді вдалося відповісти на поставлені і багато інших питань.
-? Хімічним зв'язком називають сукупність взаємодій між електронами і ядрами, що призводять до з'єднання атомів в молекулу.
Властивості хімічного зв'язку вивчають різними методами. За допомогою хімічних методів визначають число зв'язків атомів (валентність) і їх реакційну здатність.
Бутлеров створив теорію будови, згідно з якою хімічні і фізичні властивості речовин залежать не тільки від елементної формули речовини, а й від будови його молекул - близько з'єднання атомів в молекулі відповідно до їх валентністю. Речовини, що мають однакову елементну формулу, але різну будову, були названі изомерами. Наприклад, етиловий спирт і діметі- ловий ефір (застосовують для наркозу при операціях) - ізомери, так як мають однаковий елементний склад, який виражається формулою С2РНБО. Але їх хімічні та фізичні властивості сильно розрізняються.
Під дією світла хлор С1г, реагуючи з етиловим спиртом, заміщає 5, а з ефіром - 6 атомів водню. Натрій заміщає в спирті один атом водню, а з ефіром не взаємодіє. На основі таких дослідів можна зробити висновок, що 5 атомів водню спирту і 6 атомів водню ефіру пов'язані з вуглецем, а один атом водню спирту пов'язаний з киснем. Молекули мають однакове число атомів С, Н і О, але розрізняються становищем атома кисню О. Це призводить до вельми різних властивостей речовин-ізомерів.
Очевидно, що будова молекул визначаться тим, як пов'язані між собою атоми елементів, з яких складаються ці молекули. За допомогою різних реакцій були встановлені формули будови розглянутих речовин-ізомерів:
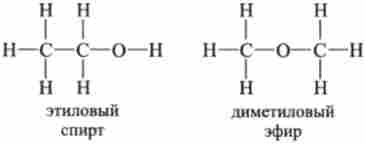
Дані формули показують, що валентність атомів вуглецю, водню і кисню в різних з'єднаннях однакова і дорівнює відповідно 4, 1, 2. У розглянутих молекулах є хімічні зв'язки одного виду: С-Н, С-О, але є і різні: С-С , О-Н. Цим і пояснюється відмінність реакційної здатності розглянутих речовин по відношенню до хлору і натрію.
За допомогою фізичних методів визначають довжину, міцність, орієнтацію і полярність хімічних зв'язків. Перераховані характеристики хімічного зв'язку зручно проілюструвати на прикладі двох простих молекул: водню Н2 і води Н20 (рис. 1.2).
Довжиною хімічного зв'язку гз називають величину, що вимірюється відстанню між ядрами пов'язують атомів. В якості одиниці вимірювання довжини хімічного зв'язку гз зручно використовувати пікометр (пм): 1 пм = 10-12 м. Характерне значення для одинарного зв'язку гз = 100 пм. Для молекули води гвін = 97 пм. Довжина зв'язку визначається рентгеноструктурньїм аналізом і іншими фізичними методами.
Міцність хімічного зв'язку Ез - величина, яка вимірюється ентальпії ДН освіти зв'язку. В якості одиниці вимірювання міцності хімічного зв'язку Ез використовують кДж / моль. Характерне значення для одинарного зв'язку
Ез = 400 кДж / моль. Для водню? нн = 430, а для води? він = 450 кДж / моль. Міцність хімічного зв'язку визначають за допомогою закону Гесса на основі ентальпій реакцій, при яких утворюється або розривається вивчається зв'язок.
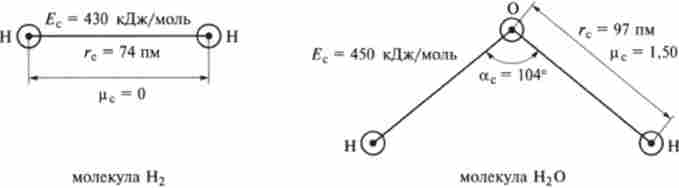
Мал. 1.2. Характеристики хімічного зв'язку на прикладі молекул Н2 і Н20
Орієнтація хімічного зв'язку Ос - величина, яка вимірюється кутом між напрямами зв'язків даного атома з сусідніми атомами молекули. Кут називають валентним.
Одиниця виміру валентного кута аз - градус. значення а може змінюватися в межах від 80 до 180 °. Для води etc = аНвін = 104 °. Для діоксиду вуглецю otoco = 180 °.
Валентні кути визначають на основі даних рентгеноструктурного аналізу та інших фізичних методів.
Полярність хімічного зв'язку р * - величина, яка вимірюється електричним моментом цих питань.
Електричний момент для двох електричних зарядів +q і -q, рівних за абсолютним значенням і протилежні за знаком, становить р = qry де г - відстань між зарядами. Такі два заряду утворюють електричний диполь:

Хімічна зв'язок поляризується, коли зв'язуються два атома з різною відносною електронегативні. В результаті на атомі з великим значенням відносної електронегативності виникає надлишковий негативний заряд - б, а на атомі з меншим значенням - надлишковий позитивний заряд +6. Полярність зв'язку розраховують за формулою
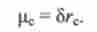
В якості одиниці вимірювання полярності хімічного зв'язку зручно використовувати позасистемна одиницю дебай (Д). 1 Д = 3,3 * Ю "30 Кл-м. полярність зв'язку
О-Н в молекулі води дорівнює рон = 1,5 Д.
Вивчення хімічного зв'язку показало, що в більшості випадків довжина, міцність, орієнтація, полярність однієї і тієї ж хімічного зв'язку в різних з'єднаннях мають приблизно однакові значення. Звідси випливає, що взаємодії, що призводять до утворення зв'язку між атомами, мають однакову природу в різних молекулах. Квантово-механічні теорії хімічного зв'язку дають пояснення цьому факту.
Е. Шредінгер вивів рівняння, що зв'язує енергію електрона і характер його руху в атомі.
На основі розрахунків за допомогою рівняння Шредінгера встановлено, що електрон рухається в певній області простору близько ядра. Цю область простору називають атомної орбиталью (АТ). Форма і розміри атомних орбіталей визначаються енергією електронів в атомі (рис. 1.3). Залежно від форми атомні орбіталі називають s-AO (сфера), р-АТ (гантель) і d-АТ (схрещені гантелі).
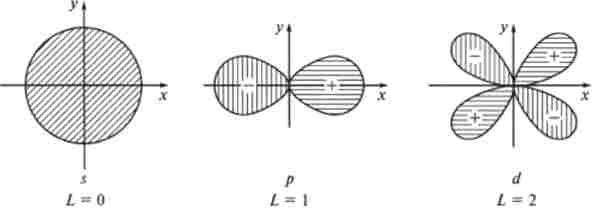
Мал. 1.3. просторова форма s-, р- і (/ -атомних орбіталей
В атомі в цілому z (Номер елемента) електронів рухаються за своїми орбиталям, створюючи єдине електронне «хмара» атома. Опис руху електронів в атомах і молекулах за допомогою АТ становить зміст квантової механіки.