| Головна |
| «« | ЗМІСТ | »» |
|---|
Вся навколишня природа поділяється на живу і неживу.
Жива природа - це різноманітні рослини і тварини, що населяють нашу планету.
Нежива природа складається з речовин небіогенного (неорганічного) походження, які містяться в земній корі і атмосфері. Біогенні речовини виходять в результаті діяльності живих організмів або витягуються з живих об'єктів фізико-хімічним шляхом.
Відповідно хімія ділиться на органічну і неорганічну. Органічна хімія на початковому етапі свого розвитку вивчала речовини тваринного і рослинного - органічного (біогенного) - походження, звідки і отримала свою назву.
Надалі хіміки-органіки довели ідентичність речовин біогенного походження і речовин, отриманих шляхом синтезу в лабораторії. У 1828 р Ф. Велер сінтезіроват сечовину з неорганічних речовин, в 1854 р П. Бертло отримав жир з гліцерину і жирних кислот, а в 1861 р А. М. Бутлеров вперше здійснив синтез глюкози з СОГ і води.
Спостережувані властивості різноманітних об'єктів навколишнього світу визначаються в кінцевому рахунку властивостями атомів - найдрібніших частинок речовини. Ця ідея була висловлена ще вченими давнину і до теперішнього часу є одним з найважливіших положень наукового пізнання природи.
У міру накопичення інформації про властивості об'єктів природи змінювалися уявлення про будову атомів. Аж до відкриття радіоактивного розпаду А. Беккерелем в 1896 р атоми вважалися неподільними частинками речовини. Саме слово «атом» перекладається з грецької мови як «неподільний».
Розвиток класичної фізики і хімії завершилося в кінці XIX в. відкриттям періодичного закону елементів Д. І. Менделєєвим і законів електродинаміки К. Максвеллом. Ці закони використовував в 1913 р датський фізик Н. Бор для побудови планетарної теорії атома. Незадовго до цього (1911) англійський фізик Е. Резерфорд здійснив досліди, з яких зробив висновок, що атоми - найдрібніші планетарні системи.
Згідно Е. Резерфорд, близько 99,9% маси атома зосереджена в ядрі - позитивно зарядженої частинки. Навколо ядра подібно до планет рухаються електрони - легкі, негативно заряджені частинки, що становлять менше 0,1% маси атома. Заряд одного електрона дорівнює 1,610 19Кл, маса 9,1 10 31 кг. Ядро найпростішого атома водню - протон - має масу 1,66 * 10 27 кг і позитивний заряд 1,6 * 10 "19 Кл.
Закон періодичності властивостей елементів - один з найважливіших законів природи - відкрив в 1869 р великий російський вчений Д. І. Менделєєв (1834-1907). До цього часу були отримані сотні різноманітних речовин, вивчені тисячі хімічних реакцій. Але весь цей величезний обсяг інформації був малоупорядочен. Хіміки погано вміли передбачати можливі реакції та їх спрямування, особливо коли це стосувалося нових речовин.
Д. І. Менделєєв, зіставляючи властивості відмінності »гих елементів і їх з'єднань, виявив систематичну повторюваність цих властивостей при збільшенні атомної маси елемента. Всі відомі на той час елементи він представив у вигляді таблиці (див. Форзац), стовпці якої утворюють групи схожих за властивостями елементів. Так була створена періодична система елементів. З її допомогою на основі типових реакцій можна прогнозувати хімічну поведінку неорганічних і біонеорганічної речовин в різних умовах. Особливо ефективне використання періодичної системи в прогнозуванні біологічної активності, зокрема токсичності, неорганічних речовин.
У сучасному формулюванні періодичний закон елементів Д. І. Менделєєва говорить:
-Властивості елементів і їх однотипних сполук перебувають у періодичній залежності від заряду атомних ядер елементів.
На практиці заряд протона 1,6 * 10 19 Кл приймають рівним одиниці і замість абсолютного значення заряду ядра qя використовують відносну величину г, що дорівнює числу протонів в ядрі.
зарядове число z атома даного елемента дорівнює номеру цього елемента в періодичній системі. Атом в цілому електронейтрален. Тому число електронів в атомі також дорівнює номеру цього елемента.
При вивченні періодичного закону необхідно уточнити зміст понять «елемент» і «однотипні з'єднання елементів».
-^ -Елементом називають сукупність атомів з однаковим зарядом ядра.
Наочне уявлення про елемент дають, наприклад, поодинокі атоми газоподібної сірки в деякому обсязі при високій температурі (рис. 1.1, а). Зниження температури призводить до з'єднання одиночних атомів S в молекули Дисер S2 (Рис. 1.1, б). При ще більш низькій температурі (нижче 350 К) з молекул Дисер утворюються кільцеві молекули октасери Sg (рис. 1.1, в). молекули S2 і Sg представляють аллотропние різновиди простих речовин - елементної сірки.
Слід мати на увазі, що в деяких підручниках, особливо перекладних, елементами нерідко називають прості речовини. Це може призвести до непорозумінь.
У 1-й половині минулого століття (1926-1928) були відкриті нові закони руху електронів і інших мікрочастинок Е. Шредінгер (1887-1961), В. Гейзенбергом (1901-1976) і П. Діраком (1902-1984). Ці закони лягли в основу одного з розділів сучасної фізики - квантової механіки. Вчені виходили з хвильових властивостей електронів. Подання про електронні хвилях лягло в основу квантової механіки і квантової хімії. Квантова механіка обгрунтувала періодичний закон елементів. За допомогою квантової хімії можна розраховувати властивості молекул і хімічні властивості речовини.
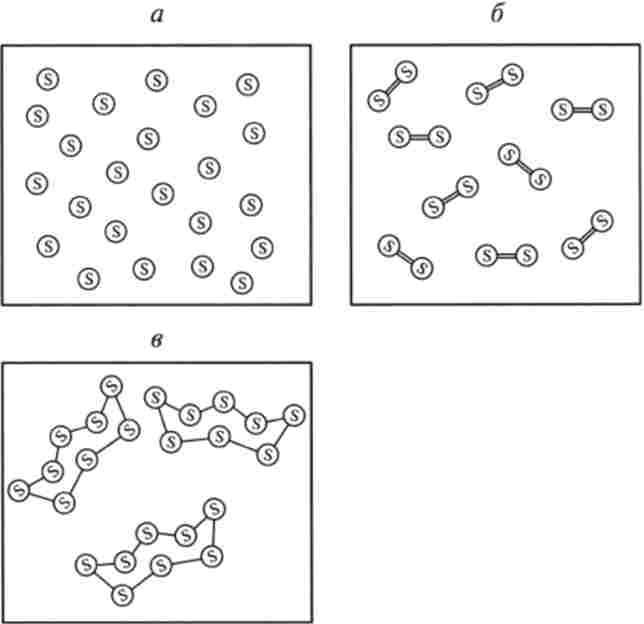
Мал. 1.1. Різні хімічні форми елементної сірки:
а - елемент (ізольовані атоми S); 6 - Дисер S2 (двоатомних молекули), в - оюасера S * (восьміатомние молекули)
Довгий час періодичний закон елементів вважався емпіричним, т. Е. Твердженням, сформульованим на основі узагальнення експериментальних даних про елементи і їх з'єднаннях. На основі періодичного закону були зроблені важливі відкриття і передбачення. Цей закон послужив однією з передумов створення квантової механіки. Але після того як була створена квантовомеханічна теорія атома, виявилося, що періодичний закон може бути визнавств з цієї теорії.
Хід пізнання властивостей елементів схематично можна зобразити у вигляді ланцюжка: експериментальні властивості речовин -? періодичний закон -? квантова теорія атома -? висновок періодичного закону -? синтез нових речовин із заданими властивостями. Подібна схема характерна для діалектичного процесу наукового пізнання в будь-якій області, в тому числі біології та медицині.
Наприклад, молекулярна генетика заснована на квантової теорії спадковості. Не дивно, що одним з основоположників молекулярної генетики став Е. Шрсдінгер, який створив квантову механіку. Грунтуючись на радиобиологічних даних російського біофізика Н. В. Тимофєєва-Ресовський (1900-1981) і виходячи з квантових уявлень, Шредінгер в 1943 р зміг розрахувати розміри гена. В кінцевому підсумку це призвело до синтезу гена і до подальшого розвитку генної інженерії. Цікаво, що схема діалектичного пізнання тут та сама, що і в хімії: відомості про спадкування ознак -? закониспадковості
Менделя-Моргана -? квантово-генетична теорія будови хромосом -? висновок законів Менделя-Моргана - "синтез гена -? створення нових організмів із заданими спадковими ознаками. Тут особливо наочно виступає глибокий зв'язок хімії та сучасної біології.