
| Головна |
| «« | ЗМІСТ | »» |
|---|
Швидкість ферментативних реакцій може бути частково знижена або повністю заблокована певними речовинами, так званими інгібіторами ферментів. Деякі інгібітори ферментів є для організму тварин і людини ефективними лікарськими речовинами, інші - смертельними отрутами.
Розрізняють три типи оборотного інгібування ферментів: конкурентне, неконкурентное і безконкурентному.
конкурентною називають інгібітор, оборотно взаємодіє з активним центром ферменту. Як правило, конкурентні інгібітори по структурі схожі на субстрат і можуть витіснятися з фермент-інгібіторного комплексу надлишком субстрату. Взаємодія з конкурентним інгібітором не призводить до денатурації або інактивації ферменту, тому при заміні інгібітора на субстрат швидкість ферментативної реакції не знижується (рис. 6. Ю).
При взаємодії ферменту з конкурентним інгібітором змінюється значення Дом відповідної ферментативної реакції.
Подібність субстрату і конкурентного інгібітору досить для взаємодії і освіти фермент-інгібіторного комплексу, але недостатньо для ферментативної реакції. Як приклад можна привести дію малоновой кислоти на реакцію, яка каталізується сукцінатдегідроге- назой і пов'язана з перетворенням бурштинової кислоти в фумаровую.

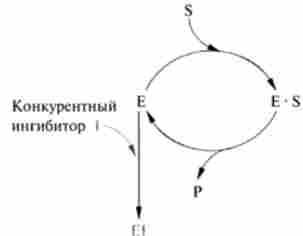
Мал. 6.10. Схема дії конкурентного інгібітору
Додавання малоновой кислоти до реакційної суміші знижує або повністю зупиняє ферментативну реакцію, так як вона є конкурентним інгібітором сукцинатдегідрогенази.

Схожість малоновой кислоти з бурштинової досить для утворення комплексу з ферментом, проте розпад цього комплексу не відбувається. При збільшенні концентрації янтарної кислоти вона витісняє малонового кислоту з комплексу, в результаті активність сукцинатдегідрогенази відновлюється.
Багато лікарські речовини пригнічують ферменти людини і тварин із конкурентного типу. Прикладом можуть служити сульфамідні препарати, за структурою схожі з л-амінобензойної кислотою (ПАБК). Це з'єднання в мікробних клітинах є інтермедіантов фолієвої кислоти - важливого компонента нуклеинового обміну. При введенні сульфамідні препаратів в організм відбувається інгібування ферментів метаболізму ПАБК, що призводить до зниження синтезу нуклеїнових кислот і загибелі мікроорганізму.

В даному випадку сульфаніламід є конкурентним інгібітором ферменту синтезу фолієвої кислоти.
У структуру пептоглікана клітинної стінки бактерій включений D-аланін, відсутній в організмі тварин і людини. Для синтезу клітинної стінки бактерії за допомогою ферменту аланин-рацемази перетворюють тваринний L-аланін в D-форму. Аланін-рацемази характерна для бактерій і не виявлена у ссавців. Отже, вона являє хорошу мету для інгібування лікарськими препаратами. Заміщення одного з протонів метильної групи на фтор дає фтораланін, з яким зв'язується аланин-рацемази, що призводить до її пригнічення.

Таким чином, можна конструювати лікарські речовини, що пригнічують активність ферментів із конкурентного типу. Щоб бути ефективним, інгібітор повинен мати високу спорідненість до ферменту. В іншому випадку необхідно призначати великі дози лікарських препаратів, щоб активно конкурувати з ендогенних субстратом за активний центр.
неконкурентні інгібітори взаємодіють з ферментами не в області активного центру, а на якомусь від нього видаленні, причому ніяким надлишком субстрату з комплексу не видаляються. При взаємодії інгібітора з ферментом відбувається зміна його конформації з наступною частковою дезінтеграцією активного центру. При взаємодії ферменту з неконкурентним інгібітором змінюється ферментативної реакції.
безконкурентному інгібування має місце, коли інгібітор взаємодіє з ферментом тільки в складі фермент-субстратного комплексу, перешкоджаючи його розпаду. Прикладом необоротного дії інгібіторів на ферменти можуть служити фосфорорганічні речовини, що застосовуються в якості інсектицидів.
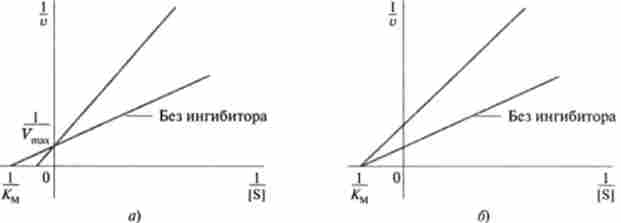
Мал. 6.11. Графік Лайнуівсра-Берка для ідентифікації різних типів інгібування: а - конкурентне інгібування; б - неконкурентное інгібування
Тип інгібування можна визначати графічно, використовуючи методи Лайнуівера-Берка або Еді-Хофсті (рис. 6.11).
Як видно з рис. 6.11, вплив конкурентного інгібітора на швидкість реакції призводить до зміни / Гм, максимальна швидкість реакції при цьому залишається без зміни. Неконкурентное інгібування пов'язано зі зниженням Vmax, без зміни константи Мехаеліса.
Активність багатьох ферментів гальмується надлишком субстрату, причому є кілька механізмів цього процесу.
Гальмування продуктами реакції пов'язане з тим, що вони можуть зв'язуватися з ферментом або з будь-яким іншим компонентом системи таким чином, що швидкість прямої реакції знижується.