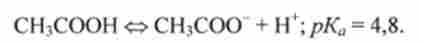
| Головна |
| «« | ЗМІСТ | »» |
|---|
Механізм буферної дії можна зрозуміти на прикладі ацетатної буферної системи CH3COONa / CH3COOH, в основі дії якої лежить кислотно-основну рівновагу:
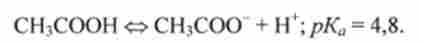
Головне джерело ацетат-іонів - сіль натрію ацетату CH3COONa, сильний електроліт:
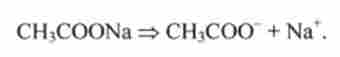
При додаванні лугу NaOH протони оцтової кислоти (резервна кислотність) вивільняються і нейтралізують додаткові іони ОН-, пов'язуючи їх в молекули води:
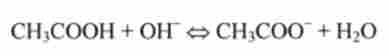
(Кислотно-основна рівновага зміщується вправо, по Лешательє). У цьому випадку також відбувається невелика зміна в співвідношенні концентрацій слабкої кислоти і її солі, а отже, і незначна зміна pH. Зменшення концентрації слабкої кислоти СН3СООН точно врівноважується підвищенням концентрації аніонів СН3СОО.
При додаванні сильної кислоти поєднане підставу СН3СОО пов'язує додаткові іони Н+, перетворюючись в слабку оцтову кислоту:
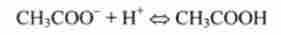
(Кислотно-основна рівновага зміщується вліво, по Лешательє).
Зменшення концентрації аніонів СН3СОО врівноважується підвищенням концентрації молекул СН3СООН. В результаті відбувається невелика зміна в співвідношенні концентрацій слабкої кислоти і її солі, а отже, і незначно змінюється pH.
Аналогічний механізм дії та інших буферних систем. Наприклад, для білкового буферного розчину, утвореного кислої і сольовий формами білка, при додаванні сильної кислоти іони Н * зв'язуються сольовий формою білка:
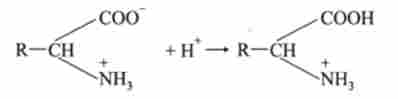
Кількість слабкої кислоти при цьому незначно збільшується, а сольовий форми білка еквівалентно зменшується. Тому pH залишається практично постійним.
При додаванні лугу до цього буферного розчину іони Н пов'язані в «білку-кислоті», вивільняються і нейтралізують додані іони ОН:
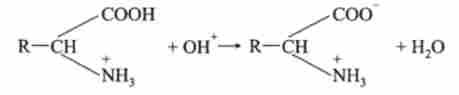
Кількість сольовий форми білка при цьому незначно збільшується, а «білка-кислоти» еквівалентно зменшується. І тому pH практично не змінюється.
Таким чином, розглянуті системи показують, що буферне дію розчину обумовлено зміщенням кислотно-лужної рівноваги за рахунок зв'язування додаються в розчин іонів Н+ і ОН- в результаті реакції цих іонів і компонентів буферної системи з утворенням малодисоційованих продуктів.
В основі розрахунку pH буферних систем лежить закон діючих мас для кислотно-лужної рівноваги. Для буферної системи 1-го типу, наприклад ацетатної, концентрацію іонів Н+ в розчині легко обчислити, виходячи з константи кислотно-лужної рівноваги оцтової кислоти:
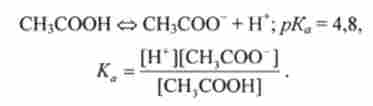
Звідси випливає, що концентрація водень-іонів дорівнює
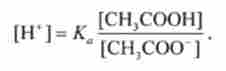
У присутності другого компонента буферного розчину - сильного електроліту CbbCOONa - кислотно-основну рівновагу оцтової кислоти СНзСООН зрушено вліво (принцип Ле Шательє). Тому концентрація недіссоціірован- них молекул СНзСООН практично дорівнює концентрації кислоти, а іонів СН3СОО - концентрації солі. У такому випадку рівняння для концентрації Н+ приймає наступний вигляд:
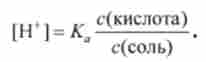
Для буферної системи 2-го типу, наприклад аміачної, концентрацію іонів Н в розчині можна розрахувати, виходячи з константи кислотно-лужної рівноваги сполученої кислоти NHV
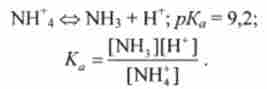
Звідси, логарифмуючи, отримують рівняння Гендерсона-Гассельбаха для буферних систем 2-го типу:
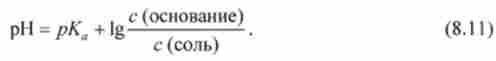
Значення pH буферних розчинів інших типів також можна розраховувати за рівнянням буферного дії. Наприклад, для фосфатной буферної системи НР04 / Н2Р04, відноситься до 3-го типу, pH можна розраховувати за рівнянням (8.11):
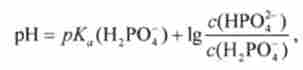
де pKJ, Н, РО ") - негативний десятковий логарифм константи дисоціації фосфорної кислоти по другого ступеня (Н2РВ ~ - слабка кислота); з (НР04") І з (Н2РВ ~) - відповідно концентрації солі і кислоти.
Рівняння Гендерсона-Гассельбаха дозволяє сформулювати ряд важливих висновків.
1. pH буферних розчинів залежить від негативного десяткового логарифма константи дисоціації слабкої кислоти рКа або підстави рКь і від відношення концентрацій компонентів КО-пари, але практично не залежить від розведення розчину водою.
Слід зазначити, що сталість pH добре виконується при малих концентраціях буферних розчинів. При концентраціях компонентів вище 0,1 моль / л необхідно враховувати коефіцієнти активності іонів системи.
2. значення рКа будь-який кислоти і рКь, будь-якого підстави можна обчислити за вимірюваним pH розчину, якщо відомі молярні концентрації компонентів.
Приклад 1. обчислити рКа молочної кислоти, якщо pH розчину, в 1 л якого міститься 0,01 моль молочної кислоти і 0,0139 моль лактат-іона (аніон молочної кислоти), дорівнює 4,0.
Відповідно до рівнянням Гендерсона-Гассельбаха (8.11)
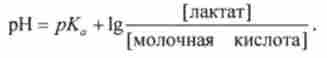
Звідси
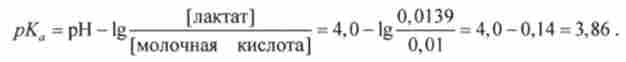
Крім того, рівняння Гендерсона-Гассельбаха дозволяє розрахувати pH буферного розчину, якщо відомі значення рКа і молярні концентрації компонентів.
3. Рівняння Гендерсона-Гассельбаха можна використовувати і для того, щоб дізнатися, в якому співвідношенні треба взяти компоненти буферної суміші, щоб приготувати розчин з заданим значенням pH.
Приклад 2. Обчислити співвідношення концентрацій CHjCOONa і СН3СООН в буферному розчині, щоб pH дорівнював 5,8 (рКл для СН3СООН дорівнює 4,8). Відповідно до рівнянням Гендерсона-Гассельбаха (8.11)
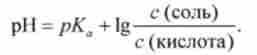
Звідси
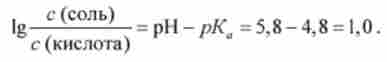
тоді

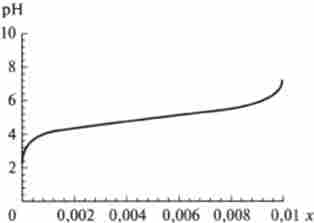
Мал. 8.4. Теоретична крива титрування оцтової кислоти (. Г - концентрація доданої лугу)
4. Рівняння Гендерсона-Гассельбаха можна використовувати для розрахунку теоретичної кривої титрування. При титруванні кислоти лугом з (сіль) дорівнює концентрації доданої лугу х, а з (Кислота) дорівнює відповідно зі (кислота) -х. Підставляючи ці значення в рівняння Гендерсона-Гассельбаха, отримують зручну для оцінки буферних можливостей системи теоретичну криву титрування (рис. 8.4).