| Головна |
| «« | ЗМІСТ | »» |
|---|
В останні десятиліття досягнуті великі успіхи в розшифровці молекулярних механізмів дії гормонів. Цьому значною мірою сприяли такі важливі події, як відкриття вторинних внутрішньоклітинних посередників (цикло-АМФ, цикло-ГМФ, фосфоінозитидів і іонів кальцію), розробка радіоізотопних методів дослідження гормональних рецепторів, а також відкриття ГТФ-зв'язуючих білків, що забезпечують передачу сигналів всередину клітини. Незважаючи на велику кількість гормонів, що володіють до того ж різноманітними функціями і мають різні структури, механізми їх дії в значній мірі уніфіковані. Можна виділити два основних механізми дії гормонів на клітини-мішені: мембрано-опосередкований, характерний для водорозчинних гормонів, нс проникаючих в клітину, а також цитозольний, за яким функціонують ліпофільні, водонерозчинні гормони, легко перетинають плазматичні мембрани.
Мембрано-опосередкований механізм. Основні цикли першого етапу передачі гормонального сигналу протікають в плазматичній мембрані. Вони пов'язані з впізнавання і трансформацією гормонального сигналу і здійснюються за допомогою складної надмолекулярной системи в кілька етапів. М. Мартін Родбелл, формалізуючи проблему з точки зору кібернетики, так позначив ці етапи: дискримінатор (рецептор) дізнається сигнал, далі відбувається перетворення його за допомогою відповідного перетворювача і, нарешті, підсилювач підсилює його на кілька порядків вже всередині клітини. Нижче наведена схема передачі інформаційного сигналу (по Rodbell).

рецептор (дискримінатор). Він селекціонує і дізнається відповідний гормон і створює умови для каскадного посилення гормонального сигналу. Рецептор представляє собою глікопротеїн, причому гликозидная частина його бере безпосередню участь в зв'язуванні гормону.
фермент аденшатцшіаза (підсилювач). Це компонент рецепторной системи, який сприймає і багаторазово підсилює гормональний сигнал. Це глікопротеїн з молекулярною масою близько 150 kDa, локалізований в цитоплазматичної мембрані. Аденилатциклаза має дві активні SH-групи та кілька аллостерічних центрів.
регулятор (перетворювач). Він являє собою білки, пов'язані і з рецептором, і заденілатциклази. Фактично це два білка, що мають спорідненість до ГТФ, тому їх називають G-білки. Один з цих білків є активатором (стимулятором) аденілатциклази (Gst), Інший - інгібітором (Ging). Кожен G-бслок складається з трьох поліпептидних ланцюгів (а, р і у). У стані «спокою» тример G-білка асоційований з ГДФ. Молекулярні механізми, пов'язані з трансляцією і посиленням сигналу, полягають в наступному. Гормон, взаємодіючи з рецептором, змінює його конформацію, при цьому відбувається дисоціація комплексу С51-білок-ГДФ. Крім того, сам G-білок дисоціює на Р, у-димер і а-суб'сдініцу, до якої приєднується ГТФ. Цей комплекс взаємодієте сульфгідрильної групою аденілатциклази і активує даний фермент. Активна аденилатциклаза каталізує процес синтезу цАМФ з АТФ. Інгібіторна дію Gj - білка
З
обумовлено тим, що його 3,5-димер перешкоджає взаємодії ГТФ з а-субодиницею G ^ -белка (рис. 11.1).

Активація аденілатциклази супроводжується розпадом ГТФ, при цьому відбувається асоціація поліпептидних ланцюгів G-білка в трімср в комплексі з ГДФ. У процесі активації аденілатциклази беруть участь Mg2+, Са2+ і Мп2+, сприяють регуляції активності ферменту.
Циклічні аденінмононуклеотіди в цитоплазмі взаємодіють з ферментом протеїнкіназою А або С, яка за відсутності цАМФ знаходиться в неактивному стані. Протеїнкіназа є тетрамер, що складається з двох каталітичних (С2) І двох регуляторних (R2) Субодиниць, який під дією цАМФ дисоціює на два димеру (рис. 11.2).
Після дисоціації протеїнкінази її каталітичні субодиниці здійснюють процес фосфорилювання білків. Приєднання фосфатной угруповання відбувається по ОН-груп амінокислотних залишків тирозину, треоніну або серину, при цьому структура і біологічна активність фосфо рілірованного білка може істотно змінюватися. Як приклад можна привести активацію фосфорилази Ь, яка під дією кінази фосфорілази b фосфорилируется і перетворюється в активну фосфорилазу а
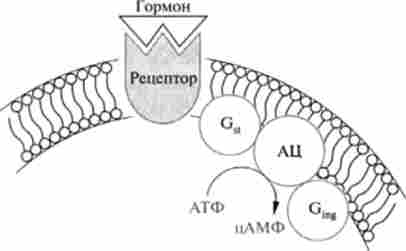
Мал. 11.1. Алснілатціклазний шлях передачі гормонального сигналу:
АЦ - аленілатііклаза: Gy - білок, що стимулює активацію аленілатііклази: GII4 - білок, що інгібує дію аденілатциклази
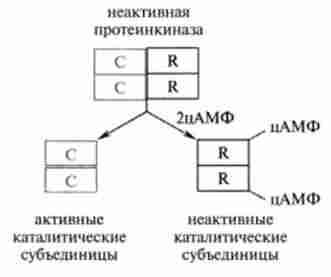
Мал. 11.2. Схема активації протеїнкінази
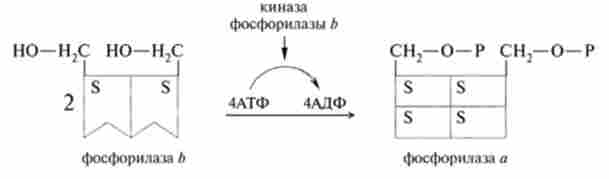
Мал. 11.3. Схема активації фосфорілази
каталізують процес відщеплення від глікогену і фосфорилювання глюкози (рис. 11.3).
Процес дефосфорилирования білків відбувається під дією ферментів групи фосфопрогеінфосфатаз. Фосфорилювання білків Памфіл-зави сімимі протєїнкиназамі не обмежується цитоплазмою. З-Каталітичні субодиниці протеїнкінази здатні перетинати ядерні мембрани і, фосфоріліруя ядерні білки - гістони, регулювати генну активність клітин.
Надмірна кількість цАМФ руйнується під дією фосфодіесте- рази. Є дві форми цього ферменту: розчинна, що активується іонами Са2+, і мембранозв'язаних, каталітична дія якої не пов'язано з Са2+. Для активації розчинної фосфоді і естерази крім іонів кальцію необхідний спеціальний кальцій-зв'язуючий білок - кальмодулін. комплекс Са2+-кальмодулин приєднується до фосфодіестерази і активує її:

Гуанілатціклазная система, подібно вищеописаної, заснована на активації гуанідатціклази і освіті цГМФ. Виявлено дві ізоформи гу анілатціклази - розчинна і мембранно-пов'язана. Остання в результаті гормонального сигналу або дії специфічних пептидів активується і каталізує синтез цГМФ за схемою:

Є сімейство цГМФ-залежних протеїнкіназ (протеїнкінази G), які здійснюють фосфорилювання білків, подібно протеїн кінази А чи С. Однак цАМФ- і цГМФ-залежну фосфорилювання білків строго специфічно, зумовлене різними ферментними системами і реалізує різні біологічні ефекти.
Са-внутрімешочний посередник гормонів. надходження Са2+ в цитоплазму клітини регулюється гормонами, селективно змінюють проникність мембран, Са2+/ Н+-АТФ-залежним насосом, а також звільненням Са2+, депонированного в мітохондріях і ЕПР. Білок кальмодулин приєднує чотири іона Са2+, що призводить до різкої зміни його конформації в основному за рахунок збільшення ступеня а-спіраліза- ції. В результаті кальмодулин-залежні ферменти можуть активуватися (инактивироваться) і змінювати швидкість залежних біохімічних процесів в клітині (рис. 11.4).
З безлічі ферментів, регульованих Са2+, слід зазначити протеїн- кінази С, фосфорилюється розчинні білки цитозоля, фосфоді і естерази і аденілатциклази, які, в свою чергу, є регуляторами процесів фосфорилювання білків. зв'язок Са2+ з гормонами очевидна, так як при його дефіциті дію гормонів припиняється. У наведеному вище прикладі фосфорилювання фосфорілази b і переведення її в активну форму істотну роль грає Са2+-кальмодулін.
Цитозольний механізм. Він характерний для ліпофільних гормонів, легко проникають в клітку. До них відносяться стероїдні гормони і деякі гормони, похідні ароматичних амінокислот. Рецептори цих гормонів локалізовані в цитоплазмі або в ядрі і являють собою перший молекулярний елемент, що сприймає позаклітинний інформаційний сигнал за допомогою специфічного зв'язування і включає ланцюг наступних подій.
Внутрішньоклітинні рецептори відносяться до складних глобулярним білків - глікопротеїну з молекулярною масою від 60 до 250 kDa. Вони мають трехдоменную структуру (рис. 11.5).
Користувачі рецептори або апорецептори в своєму складі містять білки теплового шоку: hsp 90, hsp 70 і hsp 56, які також прісосдіня-
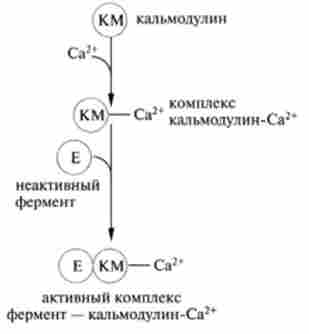
Мал. 11.4. Освіта активного комплексу фермент - кальмодулін-Са2+

Мал. 11.5. Доменна структура цитозольного рецептора:
/ - / V-кінцевий домен, що зв'язує рецептор з певними ділянками ДНК; 2 - центральний ДНК-пов'язую шин домен; 3 - З-конісвой гормон - зв'язує домен
|
Зв'язок з ядерними структурами |
рецептори |
|
Міцна зв'язок з ядром без лиганда |
Рецептори гормонів щитовидної залози |
|
Локалізовані в цитоплазмі. За відсутності ліганду можуть утворювати слабкий зв'язок з ядром. Під дією гормону афінітет до ядра різко зростає |
Рецептори стероїдних і статевих гормонів |
|
Локалізовані в цитоплазмі. У присутності ліганду афінітет до ядру слабший |
Рецептори вітаміну D |
ються до С-кінцевого домену і за відсутності ліганду підтримують рецептор в неактивному стані. Білок теплового шоку hsp 90 збільшує афінність зв'язування рецептора з гормоном, пригнічуючи разом з тим його спорідненість до компонентів ядра клітини. Приєднання до рецептора комплементарного гормону призводить до дисоціації білків теплового шоку, після чого гормон-рецеп- уторований комплекс фосфорилируется і набуває аффинность до ядер, т. Е. Активується (табл. 11.1).
Механізм передачі і трансформації гормонального сигналу здійснюється в кілька етапів (рис. 11.6).
- Транспорт гормону в клітку. Широко поширене раніше думка про те, що ліпофільні гормони проходять через біслойную мембрани клітин за допомогою простої дифузії, піддається сумніву через наявність гідрофільного шару глікопротеїнів на клітинної поверхні. більш вірогідним
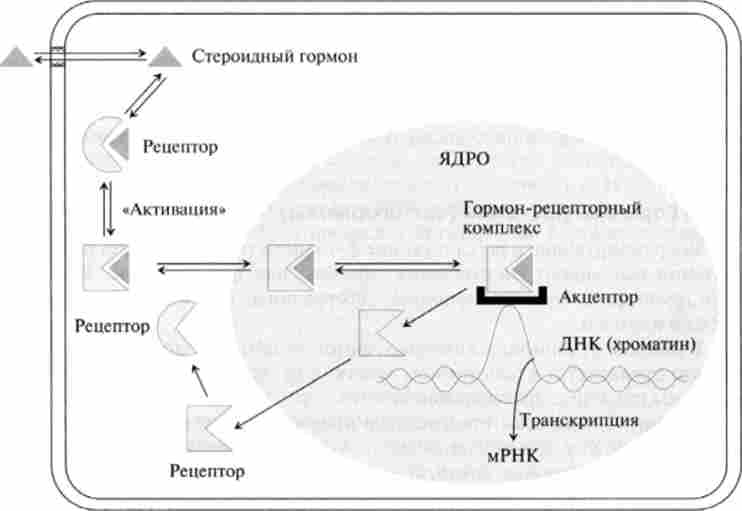
Мал. 11.6. Цитозольний механізм дії гормонів
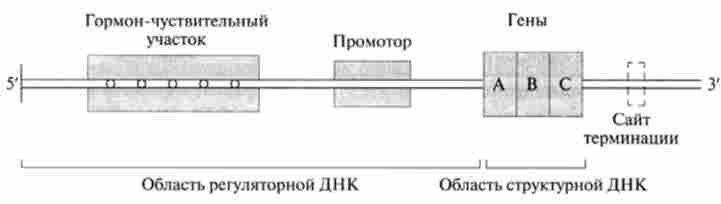
Мал. 11.7. Ділянка взаємодії гормон-рецепторного комплексу з ДНК
представляється наявність спеціальних переносників гормонів, що переносять їх всередину клітини методом полегшеної дифузії.