| Головна |
| «« | ЗМІСТ | »» |
|---|
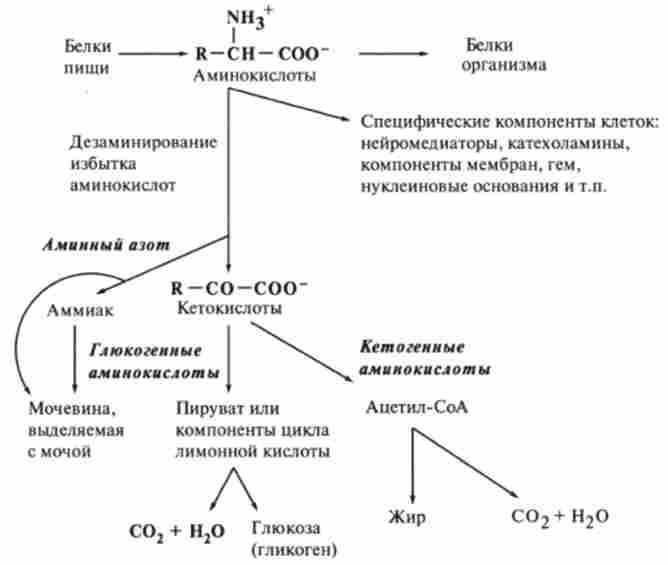
Одне з визначень говорить: «Життя - це спосіб існування білових тел». Тим самим підкреслюється, що білки і їх обмін незамінні для нормального функціонування організму і всіх процесів, що протікають в ньому (рис. 9.6).
Роль амінокислот в організмі визначається в першу чергу тим, що вони служать попередниками при синтезі білків та інших біологічно активних сполук.
Стабільність хімічного складу (гомеостаз) здорового організму є результатом рівноваги між швидкостями синтезу і розпаду його складових. Організм вищих тварин активно окисляє як екзогенні амінокислоти, джерелом яких служать переварювані харчові білки, так і ендогенні амінокислоти, які утворюються в процесі метаболічного поновлення білків самого організму.
Спрямованість і інтенсивність обміну білків визначається фізіологічним станом організму і регулюється, як і всі інші види обміну, діяльністю ЦНС.
Найбільш інтенсивно обмін білків протікає в дитячому віці, при вагітності і лактації, а також при активній м'язовій роботі, т. Е. В тих випадках, коли різко підвищується потреба в білках.
Істотний вплив на білковий обмін надає характер харчування, і зокрема кількісний і якісний склад їжі.
Таким чином, рівень білкового обміну визначається безліччю факторів, як екзогенних, так і ендогенних. Будь-які відхилення від нормального фізіологічного стану організму відбиваються на азотистом обміні.
Знання закономірностей змін метаболізму білків - важлива передумова для вибору раціону харчування і схеми тренувань для досягнення високих результатів.

Мал. 9.6. Загальна схема метаболізму амінокислот
Знання закономірностей змін обміну білків при різних хворобах - також необхідна передумова для правильної діагностики та вибору тактики терапевтичних заходів щодо усунення порушень процесу обміну.
Молекули білка і більшості олигопептидов не можуть проходити через мембрани клітин слизової оболонки кишечника. У той же час амінокислоти вільно проходять через них. Тому, щоб амінокислоти білків могли включитися в метаболізм, білки повинні гидролизоваться до амінокислот.
У ссавців гідроліз білків починається під дією шлункового соку, pH якого лежить в межах 1,0-1,5. Активним початком при цьому є протеолітичний фермент пепсин, що виділяється клітинами слизової оболонки шлунка в формі неактивного попередника (зимогена) пепсиногена. Пепсі- ноген (молярна маса 40 000 г / моль) під дією соляної кислоти НС1, що міститься в шлунковому соку, перетворюється на пепсин (молярна маса 32 700 г / моль). З шлункового соку виділено також ще один протеолітичний фермент - гастриксин.
Утворені в результаті гідролізу поліпептиди зі шлунка потрапляють в тонкий кишечник. Показник кислотності середовища кишечника підтримується в межах pH 7-8.
У кишечнику поліпептиди піддаються дії декількох протеолітичних ферментів (табл. 9.1). Деякі з них виділяються підшлунковою залозою і потрапляють в кишечник (через протоку підшлункової залози) у вигляді неактивних попередників - трипсиногена, химотрипсиногена, прокарбоксіпеп- тідаз і проеластази. У кишечнику ці зімогени перетворюються в активні форми відповідних ферментів.
Таблиця 9.1
Протеолітичні ферменти шлунково-кишкового тракту людини
|
фермент |
середа |
функція |
|
пепсин * |
Шлунковий сік |
протеиназа |
|
Гастриксин (пспсіногюлобний фермент) |
Шлунковий сік |
Протсіназа |
|
трипсин |
панкреатичний сік |
протеиназа |
|
хімотрипсин |
панкреатичний сік |
11ротеіпаза |
|
коллагеназа |
панкреатичний сік |
протеиназа |
|
Карбоксіпептілази |
панкреатичний сік |
1 (ептідази |
|
еластаза |
панкреатичний сік |
пептідаза |
|
Лмінопептілаза |
кишковий сік |
пептідаза |
|
Лейіінамінопегттідаза |
кишковий сік |
пептідаза |
|
Аланінамінопсптілаза |
кишковий сік |
пептідаза |
|
ентеропептідази |
кишковий сік |
глікопротеїн |
|
Тріпептідази |
кишковий сік |
пептідази |
|
діпептідази |
кишковий сік |
11ептілази |
|
Пролив-дипептидаза |
кишковий сік |
пептідаза |
|
Пролин-діпептілаза |
кишковий сік |
пептідаза |
- Пепсин знайдений також в шлунковому соку птахів, рептилій і риб.
Трипсиноген складається з одного поліпептидного ланцюга, що містить 249 амінокислотних залишків. Перетворення трипсиногена в активний трипсин каталізується Ентерокиназа або самим трипсином. Трипсин максимально активний при pH 7 та специфічно розщеплює пептидні зв'язки залишків аргініну або лізину в поліпептидного ланцюга.
У тонкому кишечнику хімотрипсин гідролізують пептидні зв'язку залишків триптофану, фенілаланіну і тирозину. Таким чином, хімотрипсин і трипсин доповнюють один одного в сенсі субстратної специфічності.
Крім химотрипсина і трипсину в тонкому кишечнику містяться ферменти карбокси пептідаза А, карбоксипептидаза В, а також проеластази.
Карбоксипептидази містять Zn2+ і гидролизуют все СООН-кінцеві пептидні зв'язку. Карбоксипептидаза В атакує тільки СООН-кінцеві залишки лізину або аргініну. Проеластази, яка виділяється підшлунковою залозою і перетворюється в еластазу під дією трипсину, атакує пептидні зв'язку залишків різних нейтральних амінокислот.
Стінки тонкого кишечника секретують також лейцінамінопептідази, гідроліз МН2-кінцеві пептидні зв'язку. Всупереч своїй назві, цей фермент володіє слабо вираженою специфічністю і отщепляет МН2-кінцеві залишки не тільки лейцину, а й більшості амінокислот.
В результаті комбінованої дії різних протеолітичних ферментів, що виділяються стінкою шлунка, підшлункової залозою і стінкою тонкого кишечника, що надходять з їжею білки піддаються в кінці кінців повного гідролізу до амінокислот. Вільні амінокислоти всмоктуються епітеліальними клітинами, що вистилають внутрішню поверхню тонкого кишечника. З епітеліальних клітин амінокислоти надходять в кров і розносяться по всіх тканинах. Проникнувши в клітини цих тканин, вони піддаються різним метаболічним перетворенням. Одна масть амінокислот йде на синтез білків, інша частина - на енергозабезпечення життєдіяльності (див. Рис. 9.1).