| Головна |
| «« | ЗМІСТ | »» |
|---|
Гсмопротсіни відносяться до складних білок, до складу простетичної групи яких входять іон металу і порфириновой ядро. Порфірінсодер- жащие з'єднання займають центральне положення в різних процесах життєдіяльності, наприклад, хлорофіл (магнієвий комплекс замещенного порфирина) бере участь у фотосинтезі, т. Е. В процесі, від якого д кінцевому рахунку залежить використання сонячної енергії всіма організмами (гл. 16). У цій главі розглянуто обмін складних білків, небілковий компонент яких представлений похідним порфиринов, а в якості комплексоутворюючою металу - залізо.
Родоначальником ряду порфіринів можна вважати тетрапіррольних пор- Фірін, з якого отримують всі інші порфірини, заміщаючи водневі атоми в положеннях 1-8 різними радикалами, найчастіше метильной, етільной і винильной групами або залишком пропіонової кислоти.
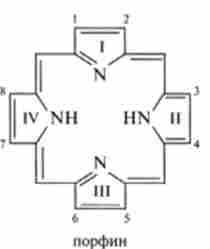
Класифікація порфиринов виходить з типу заступників його бічних ланцюгів. Найбільш важливими вважаються наступні класи: етіопорфіріни, які мають в якості заступників чотири метильние і чотири етільний групи; мезопорфіріни з чотирма метильних, двома етільний і двома карбоксівінільнимі групами; прогопорфіріни. містять чотири метильние, дві вінільні і дві карбоксіетільние групи, і копропорфірін з чотирма метильних і чотирма карбоксіетільнимі групами.
Порфірини утворюють комплекси з іонами багатьох металів, таких, як магній, залізо, цинк, нікель, кобальт, мідь і срібло. У таких комплексах іон металу знаходиться в центрі порфіринового ядра, причому його чотири ли гандних місця зайняті атомами азоту піролу. Найбільш важливе біохімічне значення мають комплекси, утворені залізом і протопорфірину IX (гл. 3). Комплекс, в якому залізо знаходиться в двовалентне стані, називається гемом, а комплекс з тривалентні залізом - гем і ном.
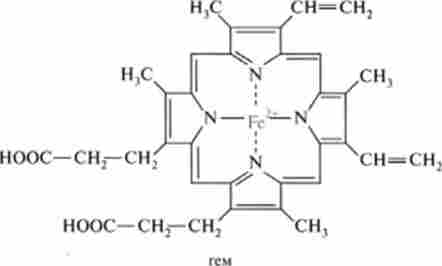
Гемоглобін здійснює перенесення кисню від легенів до різних органів, в яких протікають реакції окислення. Молекула гемоглобіну складається з двох а- і двох (5-поліпептидних ланцюгів і чотирьох гемов, з'єднаних слабкими зв'язками з глобіновой частиною (гл. 3). Гем входить до складу деяких інших білків, за своєю біохімічної функції схожих з гемоглобіном. До них відноситься миоглобин - кисневмісний білок м'язів, що складається з однієї поліпсптідной ланцюга, схожою за структурою з субодиницею гемоглобіну; цитохроми - з'єднання, що функціонують як переносники електронів в окислювально-відновних реакціях (гл. 15); каталаза і пероксидаза, каталізірующі перетворення пероксиду водню в молекулу води.
Обмін железопорфіріна буде розглянуто на прикладі розпаду і синтезу гемоглобіну - найбільш важливого і добре вивченого білка цієї групи. На рис. 25.1 представлена зведена схема послідовних стадій деградації і
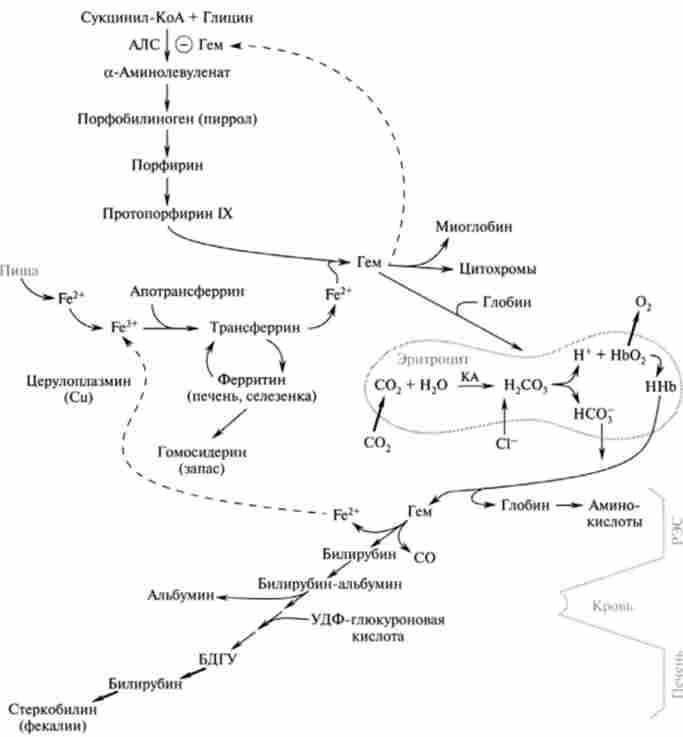
Мал. 25.1. Синтез і деградація гемоглобіну:
РЕМ - рстікулоендотсліальная система; Нь - гемоглобін; АЛС - амінолсвулінсінтаза; КА - карбоангілраза; БДГУ - білірубіндіглюкуроніл синтезу гемоглобіну, а також відображені його дихальна функція і освіту в еритроцитах крові оксигемоглобіну.
В процесі катаболізму гемоглобіну його білковий компонент (Глобино) гідролізується до амінокислот; залізо гема включається до загального пулу заліза в організмі і може знову використовуватися. Разом з тим вільна від заліза порфириновая частина гема необоротно розщеплюється до утворення жовчних пігментів, які виводяться з організму з вмістом товстого кишечника. Таким чином, гем і продукти його розпаду не можуть реутілізації в процесі синтезу порфириновой структури гемопротеинов. Синтез складного тетрапіррольних комплексу відбувається в організмі de novo з простих попередників.