| Головна |
| «« | ЗМІСТ | »» |
|---|
Спадкова інформація, що зберігається в молекулах ДНК, тиражується для того, щоб забезпечити новоутворені клітини необхідними «інструкціями» для їх нормального розвитку і функціонування. Разом з тим безпосередньої участі в життєзабезпеченні клітин ДНК не приймає. Роль посередника, функцією якого є переклад спадкової інформації, що зберігається в ДНК, в робочу форму, грають РНК - РНК.
На відміну від молекул ДНК РНК представлені однією полинуклеотидной ланцюгом, яка складається з чотирьох різновидів нуклеотидів, що містять цукор, рибозу, фосфат і одне з чотирьох азотистих основ - аденін, гуанін, урацил або цитозин. РНК синтезується на молекулах ДНК за допомогою ферментів РНК-полімерази з дотриманням принципу комплементарно- сти і антипаралельності, причому аденіну ДНК в РНК комплементарний урацил. Все різноманіття РНК, що діють в клітці, можна розділити на три основних види: мРНК, тРНК, рРНК.
Для того щоб синтезувати білки із заданими властивостями, до місця їх побудови надходить «інструкція» щодо порядку включення амінокислот в пептидних ланцюг. Ця інструкція укладена в нуклеотидної послідовності матричних, або інформаційних, РНК (мРНК, іРНК), синтезованих на відповідних ділянках ДНК. Процес синтезу мРНК називають транскрипцією.
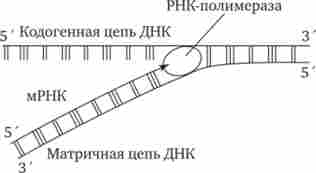
Мал. 3.24. Схема синтезу мРНК.
Матрицею для транскрипції мРНК служить кодогенная ланцюг ДНК, звернена до ферменту своїм З'-кінцем
Синтез мРНК починається з виявлення РНК-полімераза особливого ділянки в молекулі ДНК, який вказує місце початку транскрипції - промотора. Після приєднання до промотор РНК-полімераза розкручує прилегла виток спіралі ДНК. Дві ланцюга ДНК в цьому місці розходяться, і на одній з них фермент здійснює синтез мРНК. Збірка рибонуклеотидов в ланцюг відбувається з дотриманням їх комплементарності нуклеотидів ДНК, а також антипараллельно по відношенню до матричного ланцюга ДНК. У зв'язку з тим, що РНК-полімераза здатна збирати полинуклеотид лише від 5'-кінця до -кінцю, матрицею для транскрипції може служити тільки одна з двох ланцюгів ДНК, а саме та, яка звернена до ферменту своїм З'-кінцем ( 3 '-> 5'). Таку ланцюг називають матричної. Ланцюг молекули ДНК, що кодує матричну, називається кодогенной (5'-З'Хріс. 3.24). Антипаралельність з'єднання двох полінуклеотід- них ланцюгів в молекулі ДНК дозволяє РНК-полімерази правильно вибрати матрицю для синтезу мРНК.
Просуваючись уздовж матричної ланцюга ДНК, РНК-полімераза здійснює поступове точне переписування інформації до тих пір, поки вона не зустрічає специфічну нуклеотидну послідовність - термінатор транскрипції. У цій ділянці РНК-полімераза відокремлюється як від матриці ДНК, так і від знову синтезованої мРНК (рис. 3.25). Фрагмент молекули ДНК, що включає промотор, транскрібіруемих послідовність і термінатор, утворює одиницю транскрипції - транскріптон.
У процесі синтезу, у міру просування РНК-полімерази уздовж молекули ДНК, пройдені нею одноцепочечниє ділянки ДНК знову об'єднуються в подвійну спіраль. Утворена в ході транскрипції мРНК містить інформацію, записану в відповідній ділянці ДНК. Трійки поруч стоять нуклеотидів мРНК, шифрувальні амінокислоти, називають кодонами. Послідовність кодо- новий мРНК шифрує послідовність амінокислот у пептидного ланцюга. Кодонам мРНК відповідають певні амінокислоти (табл. 3.1).
Таблиця 3.1. Генетичний код мРНК (підкреслені кодони-термінатори)
другий нуклеотид
|
У |
Ц |
А |
Г | ||||||||
|
п е Р В и й н У до л е про т і Д |
У |
УУУ УУЦ УУА УУГ |
фен лей |
УЦУ УЦЦ Уца УЦГ |
сер |
УАУ УУЦ УАА УАГ |
тир стоп |
УГУ УДЦ УГА УГГ |
цис стоп Три |
У Ц А Г |
Т Р е т і й н У до л е про т і д |
|
Ц |
ЦУУ ЦУЦ ЦУА ЦУГ |
лей |
ЦЦУ ЦЦЦ ЦЦА ццг |
про |
ЦАУ цяць ЦАА ЦАГ |
Гіс Глн |
ЦГУ ЦГЦ ЦГА ЦГГ |
Apr |
У Ц А Г |
||
|
А |
АУУ АУЦ АУА АУГ |
Ілі мет |
АЦУ АЦЦ АЦА АЦГ |
Тре |
ААУ ВАЦ ААА ААГ |
АСН Ліз |
АМУ АГЦ АГА АГГ |
сер арг |
У Ц А Г |
||
|
Г |
ГУУ Не имеет значения Гуц ГУА ГУГ |
Вал |
ГЦУ ГЦЦ ГЦА ГЦГ |
Ала |
ГАУ ГАЦ ДАА ГАГ |
асп гли |
ДКУ ГГЦ МДА ГГГ |
попелиці |
У ц А Г |
||
Важлива роль в процесі використання спадкової інформації кліткою належить транспортній РНК (тРНК). Доставляючи необхідні амінокислоти до місця збірки пептидних ланцюгів, тРНК виконує функцію трансляційного посередника.
Молекули тРНК являють собою полінуклеотидні ланцюга, синтезовані на певних послідовностях ДНК. Вони складаються з відносно невеликого числа нуклеотидів - 75-95. В результаті комплементарного з'єднання підстав, які знаходяться в різних ділянках полінуклеотидних ланцюга тРНК, вона набуває структуру, що нагадує за формою лист конюшини (рис. 3.26).
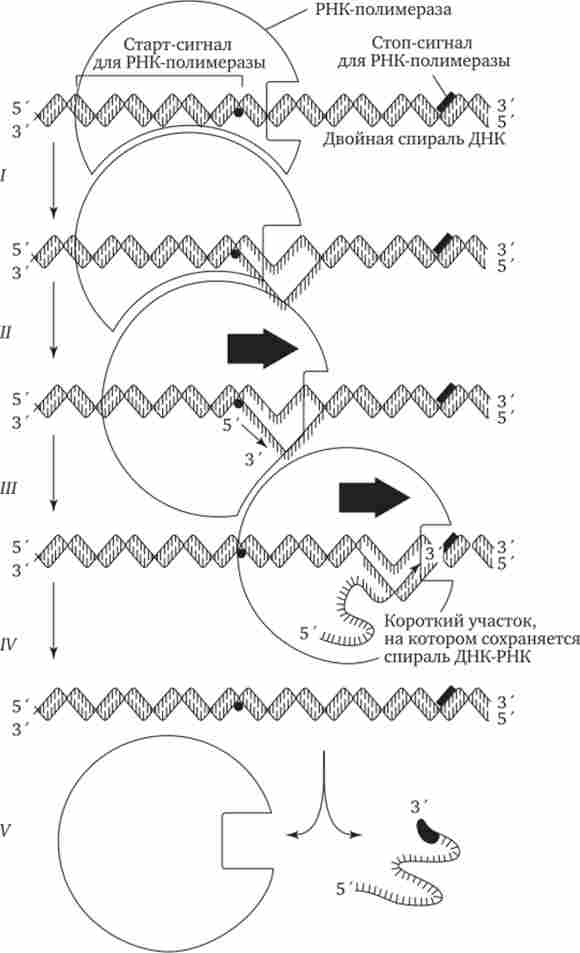
Мал. 3.25. Роль РНК-полімерази в транскрипції.
/ - виявлення промоторной області в молекулі ДНК і розкручування спіралі ДНК; II - ініціація синтезу ланцюга РНК шляхом скріплення двох перших рібонуклео- зідтріфосфатов; III - нарощування ланцюга РНК в напрямку 5 ' -> 3 'шляхом приєднання рибонуклеозидтрифосфатов; IV- вивільнення 5'-кінця синтезується РНК і відновлення подвійної спіралі ДНК; V - закінчення синтезу РНК в області термінатора, відділення полімерази від завершеною ланцюга РНК
У ній виділяють чотири головні частини, що виконують різні функції. акцепторні «Стебло» утворюється двома комплементарно з'єднаними кінцевими частинами тРНК. Він складається з семи пар основ. З'-кінець цього стебла трохи довший і формує одноланцюговий ділянку, який закінчується послідовністю ЦЦА з вільною ОН-групою. До цього кінця приєднується транспортується амінокислота. Решта три гілки є комплементарно спарені послідовності нуклеотидів, які закінчуються неспареними ділянками, що утворюють петлі. Середня з цих гілок - антікодо- нова - складається з п'яти пар нуклеотидів і містить в центрі своєї петлі антикодон. антикодон - це три нуклеотиду, комплементарні кодону мРНК, який шифрує амінокислоту, що транспортується даної тРНК до місця синтезу пептиду.
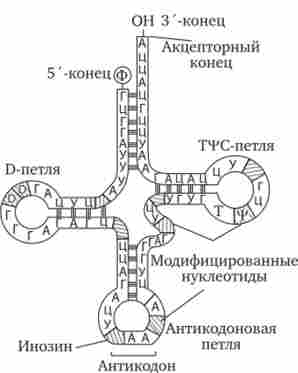
Мал. 3.26. Будова типовою молекули тРНК
Між акцепторной і антикодоновой гілками розташовуються дві бічні гілки. У своїх петлях вони містять модифіковані підстави - дігідроурідін (D-петля) і триплет Тц / С, де ц / - псевдоуріаін (Т | / С-петля). Між антикодоновой і Т | / С-гілками міститься додаткова петля, що включає від 3-5 до 13-21 нуклеотидів.
В цілому різні види тРНК характеризуються певною сталістю нуклеотидної послідовності, яка найчастіше складається з 76 нуклеотидів. Варіювання їх числа пов'язано головним чином зі зміною кількості нуклеотидів у додатковій петлі. Комплементарні ділянки, що підтримують структуру тРНК, як правило, консервативні. Первинна структура тРНК, що визначається послідовністю нуклеотидів, формує вторинну структуру тРНК, що має форму листа конюшини. У свою чергу, вторинна структура обумовлює тривимірну третинну структуру, для якої характерним є утворення двох перпендикулярно розташованих подвійних спіралей (рис. 3.27). Одна з них утворена акцепторной і Т | ГС-гілками, інша - антикодоновой і D-гілками.
На кінці однієї з подвійних спіралей розташовується транспортується амінокислота, на кінці іншої - антикодон. Ця ділянки виявляються максимально віддаленими одна від одної. Стабільність третинної структури тРНК підтримується завдяки виникненню додаткових водневих зв'язків між основами полі- нуклеотидной ланцюга, що знаходяться в різних її ділянках, але просторово зближених в третинної структурі.
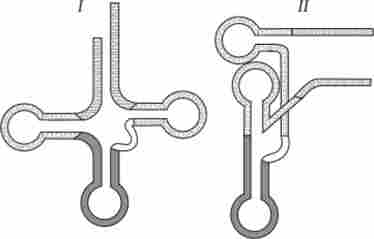
Мал. 3.27. Просторова організація тРНК.
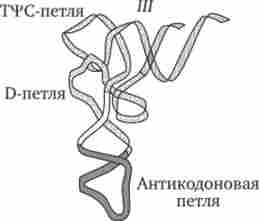
I - вторинна структура тРНК у вигляді «конюшини», яка визначається її первинною структурою (послідовністю нуклеотидів у ланцюгу); II - двовимірна проекція третинної структури тРНК; III - схема укладання молекули тРНК в просторі
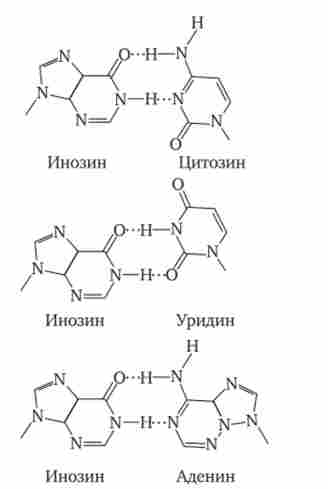
Мал. 3.28. З'єднання инозина водневими зв'язками з трьома різними азотистими підставами.
Водневі зв'язки позначені точками
Різні види тРНК мають схожу третинну структуру, хоча і з деякими варіаціями.
Однією з особливостей тРНК є наявність в ній незвичайних підстав, що виникають внаслідок хімічної модифікації вже після включення нормального підстави в полінуклеотидних ланцюг. Ці змінені підстави обумовлюють велику структурний різноманіття тРНК при загальному плані їх будови. Найбільший інтерес представляють модифікації підстав, які формують антикодон, які впливають на специфічність його взаємодії з кодоном. Наприклад, нетипове підставу інозин, іноді стоїть в 1-му положенні антикодону тРНК, здатний комплементарно з'єднуватися з трьома різними третіми підставами кодону мРНК - У, Ц і А (рис. 3.28). Так як однієї з особливостей генетичного коду є його вирожденність (див. Розд. 3.4.1.2), багато амінокислот шифруються кількома кодонами, які, як правило, відрізняються своїм третім підставою. Завдяки відсутності адресності зв'язування модифікованого підстави антикодону одна тРНК дізнається кілька кодонів-синонімів.
Встановлено також існування декількох видів тРНК, здатних з'єднуватися з одним і тим же кодоном. В результаті в цитоплазмі клітин зустрічається не 61 (за кількістю кодонів), а близько 40 різних молекул тРНК. Цієї кількості достатньо, щоб транспортувати 20 різних амінокислот до місця збірки білка.
Поряд з функцією точного впізнавання певного кодону в мРНК молекула тРНК здійснює доставку до місця синтезу пептидного ланцюга строго певної амінокислоти, зашифрованою за допомогою даного кодону. Специфічне з'єднання тРНК зі «своєї» амінокислотою протікає в два етапи і призводить до утворення сполуки, званого аміноацил-тРНК (Рис. 3.29).
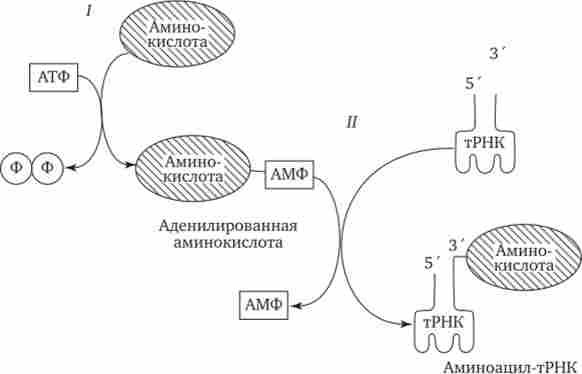
Мал. 3.29. Приєднання амінокислоти до відповідної тРНК.
I - 1-й етап, взаємодія амінокислоти і АТФ з виділенням пірофосфату;
II - 2-й етап, приєднання аденілірованной амінокислоти до -кінцю РНК
На першому етапі амінокислота активується, взаємодіючи своєї карбоксильною групою з АТФ. В результаті утворюється адені- ліровать амінокислота.
На другому етапі ця сполука взаємодіє з ОН-групою, що знаходиться на -кінці відповідної тРНК, і амінокислота приєднується до нього своєю карбоксильною групою, вивільняючи при цьому АМФ. Таким чином, цей процес протікає з витратою енергії, одержуваної при гідролізі АТФ до АМФ.
Специфічність з'єднання амінокислоти і тРНК, що несе відповідний антикодон, досягається завдяки властивостям ферменту аміноацил-тРНК-синтетази. У цитоплазмі існує цілий набір таких ферментів, які здатні до просторового пізнанню, з одного боку, своєю амінокислоти, а з іншого - відповідного їй антикодону тРНК (рис. 3.30).
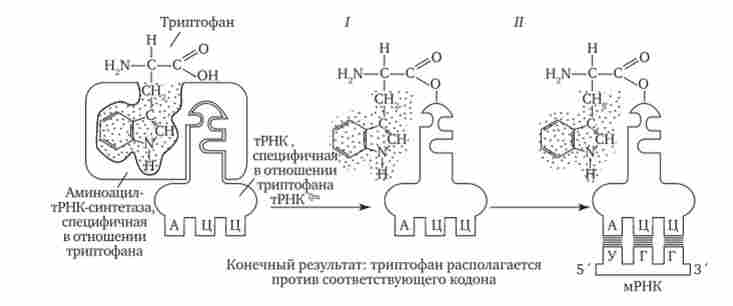
Мал. 3.30. Схема трансляції генетичного коду.
1 - приєднання амінокислоти (триптофану) до відповідної тРНК за допомогою ферменту аміноацил-тРНК-синтетази; II - приєднання тРНК, що несе свою амінокислоту, до мРНК завдяки зв'язуванню її антикодону з кодоном мРНК
Спадкова інформація, «записана» в молекулах ДНК і «переписана» на мРНК, розшифровується в ході трансляції завдяки двом процесам специфічного впізнавання молекулярних поверхонь. Спочатку фермент аміноацил-тРНК-синтетаза забезпечує з'єднання тРНК з транспортується нею амінокислотою. Потім аміноацил-тРНК комплементарно злучається з мРНК завдяки взаємодії антикодону з кодоном. За допомогою системи тРНК мова нуклеотидної ланцюга мРНК транслюється в мову амінокислотної послідовності пептиду (рис. 3.30).
Процес взаємодії мРНК і тРНК, що забезпечує трансляцію інформації з мови нуклеотидів на мову амінокислот, здійснюється на рибосомах. Останні являють собою складні комплекси рРНК і різноманітних білків, в яких перші утворюють каркас. Хвороби є не тільки структурним компонентом рибосом, але і забезпечують зв'язування їх з певною нуклеотидної послідовністю мРНК. Цим встановлюються початок і рамка зчитування при утворенні пептидного ланцюга. Крім того, вони забезпечують взаємодію рибосоми і тРНК. Численні білки, що входять до складу рибосом поряд з рРНК, виконують як структурну, так і ферментативну роль.
Рибосоми про- і еукаріот дуже схожі за структурою і функціями. Вони складаються з двох субчастиц: великої і малої. У еукаріот мала субчастіца утворена однією молекулою рРНК і 33 молекулами різних білків. Велика субчастіца об'єднує три молекули рРНК і близько 40 білків. Прокаріотичні рибосоми і рибосоми мітохондрій і пластид містять менше компонентів.
В рибосомах є дві борозенки. Одна з них утримує зростаючу поліпептидний ланцюг, інша - мРНК. Крім того, в рибосомах виділяють дві ділянки, що зв'язують тРНК. У аміноацільном A-ділянці розміщується аміноацил-тРНК, що несе певну амінокислоту. У пептідільний П-ділянці розташовується зазвичай тРНК, яка навантажена ланцюжком амінокислот, сполучених пептидними зв'язками. Освіта А- і П-ділянок забезпечується обома субчастиц рибосоми.
У кожен момент рибосома екранує сегмент мРНК протяжністю близько 30 нуклеотидів. При цьому забезпечується взаємодія тільки двох тРНК з двома розташованими поруч кодонами мРНК (рис. 3.31).
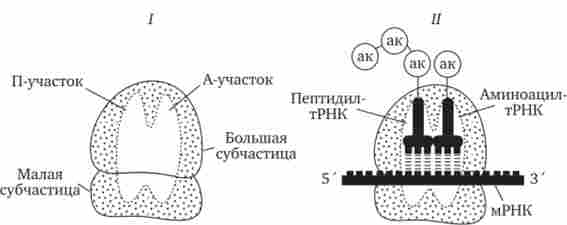
Мал. 3.31. Ділянки зв'язування молекул тРНК і рибосоми.
I - Ненавантажена рибосома; Я - навантажена рибосома; ак - амінокислота
Трансляція інформації на «мову» амінокислот виражається в поступовому нарощуванні пептидного ланцюга відповідно до інструкції, укладеної в мРНК. Цей процес протікає на рибосомах, які забезпечують послідовність розшифровки інформації за допомогою тРНК. Під час трансляції можна виділити три фази: ініціацію, елонгацію і терминацию синтезу пептидного ланцюга.
Фаза ініціації, або початок синтезу пептиду, полягає в об'єднанні двох знаходяться до цього порізно в цитоплазмі субчастиц рибосоми на певній ділянці мРНК і приєднання до неї першої аміноацил-тРНК. Цьому задається також рамка зчитування інформації, що містяться в мРНК (рис. 3.32).
У молекулі будь-мРНК поблизу її 5'-кінця є ділянка, комплементарний рРНК малої субодиниці рибосоми і специфічно впізнаваний нею. Поруч з ним розташовується ініціює стартовий кодон АУГ, шифрує амінокислоту метіонін. Мала субчастіца рибосоми з'єднується з мРНК таким чином, що стартовий кодон АУГ розташовується в області, що відповідає П-ділянці.
При цьому тільки ініціює тРНК, несуча метіонін, здатна зайняти місце в недобудованому П-ділянці малої субчастіци і комплементарно з'єднатися зі стартовим кодоном. Після описаного події відбувається об'єднання великої і малої субчастиц рибосоми з утворенням її пептідільний і аміноацільного ділянок (див. Рис. 3.32).
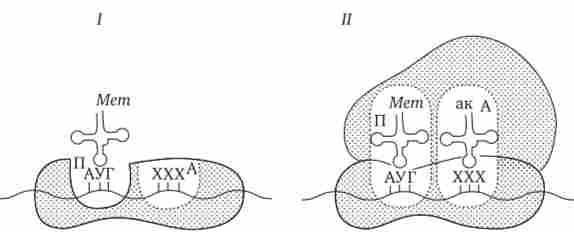
Мал. 3.32. Ініціація білкового синтезу.
I - з'єднання малої субчастіци рибосоми з мРНК, приєднання до стартового кодону несучої метіонін тРНК, яка розташовується в недобудованому П-ділянці; II- з'єднання великої і малої субчастиц рибосоми з утворенням П- і A-ділянок; наступний етап пов'язаний з розміщенням в A-ділянці аміноацил-тРНК, що відповідає розташованому в ньому кодону мРНК, - початок елонгації; ак - амінокислота
До кінця фази ініціації П-ділянка зайнята аміноацил-тРНК, пов'язаної з метіоніном, тоді як в A-ділянці рибосоми розташовується наступний за стартовим кодон.
Описані процеси ініціації трансляції катализируются особливими білками - факторами ініціації, які рухомо пов'язані з малої субчастиц рибосоми. По завершенні фази ініціації і освіти комплексу рибосома - мРНК - ініціює аміноацил-тРНК ці фактори відокремлюються від рибосоми.
Фаза елонгації, або подовження пептиду, включає в себе всі реакції від моменту утворення першої пептидного зв'язку до приєднання останньої амінокислоти. Вона являє собою циклічно повторюються події, при яких відбувається специфічне впізнавання аміноацил-тРНК чергового кодону, що знаходиться в A-ділянці, комплементарна взаємодія між антикодоном і кодоном.
Завдяки особливостям тривимірної організації тРНК (див. Розд. 3.4.3.1) при з'єднанні її антикодону з кодоном мРНК транспортується нею амінокислота розташовується в A-ділянці, поблизу від раніше включеної амінокислоти, що знаходиться в П-ділянці. Між двома амінокислотами утворюється пептидний зв'язок, каталізу- емая особливими білками, що входять до складу рибосоми. В результаті попередня амінокислота втрачає зв'язок зі своєю тРНК і приєднується до аміноацил-тРНК, розташованої в A-ділянці. Що знаходиться в цей момент в П-ділянці тРНК вивільняється і йде в цитоплазму (рис. 3.33).
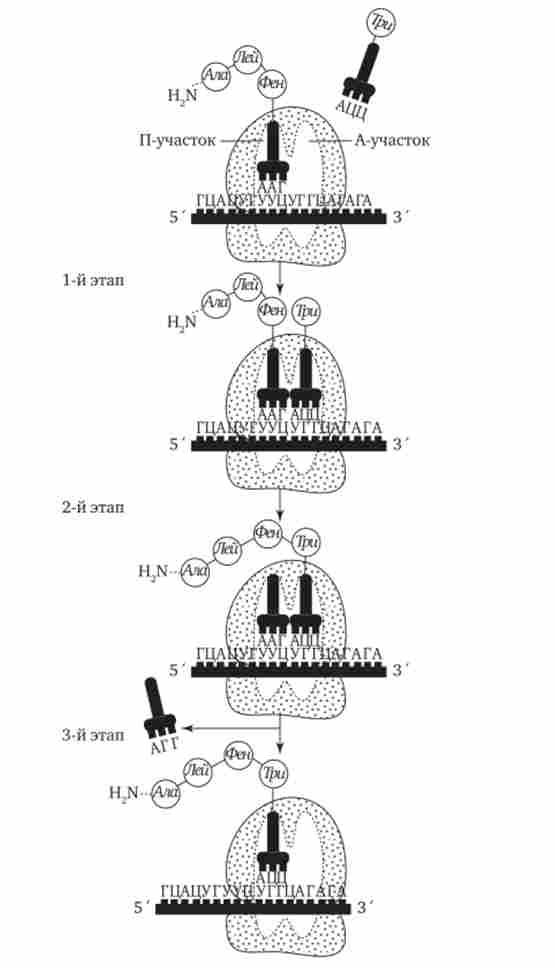
Мал. 3.33. Фаза елонгації в синтезі білка.
Переміщення тРНК, навантаженої пептидного ланцюжком, з A-ділянки в П-ділянку супроводжується просуванням рибосоми по мРНК на крок, що відповідає одному кодону. Тепер наступний кодон приходить в контакт з А-ділянкою, де він буде специфічно «пізнаний» відповідної аміноацил-тРНК, яка розмістить тут свою амінокислоту. Така послідовність подій повторюється до тих пір, поки в А-ділянка рибосоми вступить кодон-термінатор, для якого не існує відповідної тРНК.
Збірка пептидного ланцюга здійснюється з досить великою швидкістю, яка залежить від температури. У бактерій при 37 ° С вона виражається в додаванні до поліпептид від 12 до 17 амінокислот у 1 с. У клітині ця швидкість нижча і виражається в додаванні двох амінокислот в 1 с.
Фаза термінації, або завершення синтезу поліпептиду, пов'язана з впізнавання специфічним рибосомні білком одного з терминирующего кодонів (УАА, УАГ або УГА), коли той входить в зону A-ділянки рибосоми. При цьому до останньої амінокислоті в пептидного ланцюга приєднується вода, і її карбоксильний кінець відокремлюється від тРНК. В результаті завершена пептидная ланцюг втрачає зв'язок з рибосомою, яка розпадається на дві субчастіци (рис. 3.34).
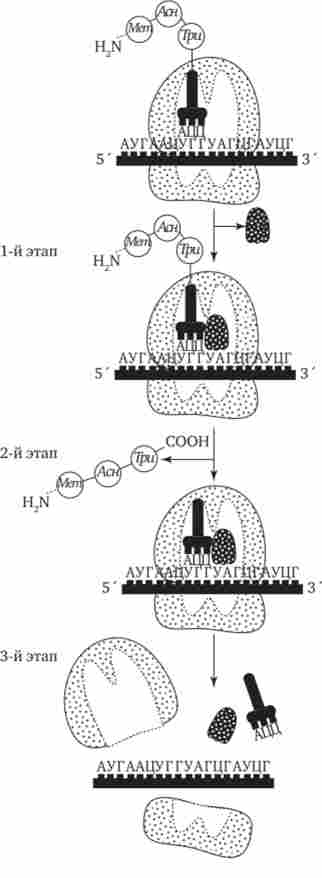
Мал. 3.34. Терминация синтезу пептидного ланцюга.
1-й етап - приєднання фактора звільнення до стоп-кодону; 2-й етап - термінація, вивільнення завершеного пептиду; 3-й етап - дисоціація рибосоми на дві субчастіци