
| Головна |
| «« | ЗМІСТ | »» |
|---|
З ацинарной частини підшлункової залози в просвіт дванадцятипалої кишки секретируются травні ферменти, в той час як островковая (ендокринна) частину секретує в панкреатичну вену наступні
Таблиця 13.2. Типи клітин в острівцях Лангерганса (по Маррі)
|
Тип клітин |
Відносний вміст,% |
Утворений гормон |
|
а |
25 |
глюкагон |
|
Р |
70 |
інсулін |
|
Ь |
5 |
соматостатін |
гормони: інсулін, глюкагон і соматостатин. Острівкова частина складається з клітин різного типу, причому кожен з них синтезує і секретує певний гормон (табл. 13.2).
Інсулін був вперше виділений з підшлункової залози бика в 1921 р Ф. Бантінгом і Ч. Бестом. Він складається з двох поліпептидних ланцюгів, з'єднаних двома дисульфідними зв'язками. Поліпептидний ланцюг А містить 21 амінокислотний залишок, а ланцюг В - 30 амінокислотних залишків, молску-
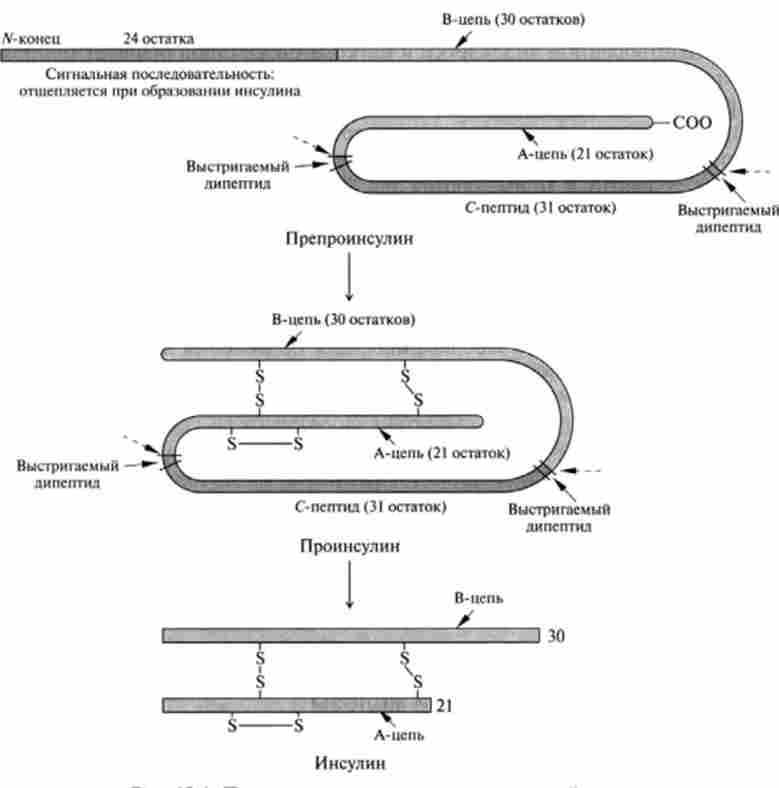
Мал. 13.1. Процесинг інсуліну в підшлунковій залозі лярная маса інсуліну 5,7 kDa. Нижче представлена амінокислотна послідовність інсуліну людини:

Структура інсуліну досить консервативна. Амінокислотна послідовність інсуліну людини і багатьох тварин різниться за все на 1-2 амінокислоти. У риб у порівнянні з тваринами В-ланцюг більше і містить 32 амінокислотних залишку.
Біосинтез. У тварин і людини інсулін синтезується в Р-клітинах острівців Лангерганса. Гени, що кодують цей білок у людини, локалізовані в короткому плечі 11-ї хромосоми. Зріла інсулінова мРНК складається з 330 нуклеотидів, що відповідає 110 амінокислотним залишкам. Саме таке їх кількість містить попередник інсуліну - препроинсулин. Він складається з одного поліпептидного ланцюга, на / V-кінці якої знаходиться сигнальний пептид (24 амінокислоти), а між А- і В-ланцюгами локалізована С-пептид, що містить 35 амінокислотних залишків.
Процес дозрівання інсуліну починається в цистернах ендоплазматичної, де під дією ферменту сігналази с / V-кон ца отщепляется сигнальний пептид. Далі в апараті Гольджі під дією ендопептідаз вирізається С-пептид і утворюється зрілий інсулін (рис. 13.1). на транс-стороні апарату Гольджі новосинтезовані гормон з'єднується з цинком, утворюючи надмолекулярних структури (три-, тетра-, пента- і гексамери), що переміщаються потім в секреторні гранули (рис. 13.2).
Мал. 13.2. Трімср Zn-інсулін
Останні відділяються від апарату Гольджі, переміщаються до цитоплазматичної мембрани, асоціюються з нею, і інсулін секретується в кров'яне русло. Швидкість секреції гормону визначається концентрацією глюкози і іонів Са2+ у крові. Адреналін пригнічує звільнення інсуліну, а такі гормони, як ТТГ і АКТГ, навпаки, сприяють його секреції. У крові інсулін перебуває в двох формах: вільної та зв'язаної з білками, переважно з трансферином і а2-глобуліном. Час «напівжиття» інсуліну становить близько п'яти хвилин, причому розпад починається в крові, так як в еритроцитах є інсулінові рецептори і досить активна інсулін-деградуюча система.
Інсулінази еритроцитів є Са-залежної, тіоловою протеиназой, функціоніруюшей спільно з глутатіон-інсулін-трансгідрогеназой, що розщеплює дісульфіднис зв'язку між двома поліпептидними ланцюгами інсуліну.
(!) Фрагментація інсуліну і його розпад відбуваються переважно
в печінці, нирках і плаценті.
Фрагменти інсуліну мають біологічну активність і беруть участь в ряді метаболічних процесів. Мутації в структурі інсулінового гена, порушення механізмів посттранскрипційна і посттрансляційних процесингу призводять до утворення дефектних молекул інсуліну і, як наслідок, до порушення обмінних процесів, які регулюються даним гормоном. В результаті розвивається важке захворювання - цукровий діабет.
Біохімічні функції. Однією з основних функцій інсуліну є регуляція транспорту глюкози, амінокислот, іонів та інших метаболітів в клітини печінки, нирок, жйровой тканини та інших органів. Механізм дії цього гормону відрізняється ог такого для інших пептидних гормонів і є унікальним в регуляції метаболічних процесів. Інсуліновий рецептор являє собою тетрамер, що складається з двох а- і двох р-суб'сді- ниць, одна з яких має тірозінкіназной активністю. Інсулін при взаємодії з а-субодиницям і, розташованими на поверхні цитоплазматичної мембрани, утворює гормон-рецепторний комплекс. Кон- формаційні зміни тетрамера призводять до активації трансмембранної Р-субодиниці рецептора, яка має тірозінкіназной активністю. Активна гірозінкіназа здатна як до аутофосфорілірованію, так і до локального фосфорилированию прилеглих мембранних білків. В результаті фосфорилювання утворюються мембранні канали, через які глюкоза та інші метаболіти проникають в клітини. Через певний часовий інтервал відбувається інтерналізація гормон-рецепторного комплексу всередину клітини, де він дисоціює на вільні рецептор і гормон. Рецептор надходить в апарат Гольджі, де «ремонтується», а потім переміщається на зовнішню мембрану для подальшого функціонування. Цей процес називається Рециклизация інсулінового рецептора. Вільний інсулін під дією тканинної інсулінази розпадається на сім фракцій, п'ять з яких мають біологічну активність. Так, вони здатні активувати 6 $ -белкі рибосом, що володіють протеінкіназной активністю. В результаті стимулюється ініціація трансляції та біосинтез білка.
Крім того, інсулін стимулює ряд біосинтетичних процесів: синтез нуклеотидів, нуклеїнових кислот, ферментів гліколізу і пентозофос- фатного циклу, глікогену. У жирової тканини інсулін активує процес освіти ацетил КоА і жирних кислот. Він є одним з індукторів синтезу холестерину, а також гліцерину і гліцераткінази.