| Головна |
| «« | ЗМІСТ | »» |
|---|
Що ж відбувається з поліпептидного ланцюгом після звільнення її з рибосоми? Ще на рибосомі починається процес часткового формування вторинної структури білка. Після утворення 25-30-членного поліпептиду / V-конеі виходить з рибосоми і процес скручування білка триває поза нею. Це надає структурі жорсткість, необхідну для перетину мембрани ЕПР (рис. 24.4).
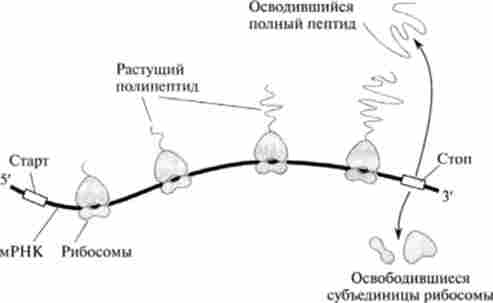
Мал. 29.4. Звільнення білка з рибосоми
Процес закручування поліпептидного ланцюга відбувається за допомогою спеціальних білків - Шапірон (гл. 3). При синтезі мембранних і секреторних білків, починаючи з jV-кінця поліпептидного ланцюга, від 10 до 30 амінокислотних залишків утворюють сигнальну послідовність, що складається з гідрофобних амінокислот. У клітинах існують вільні і мембранно-зв'язані рибосоми, причому зв'язування їх з мембраною ЕР визначається в основному сигнальної послідовністю зростаючого поліпептиду. У мембранах ЕР знайдені два глікопротсіна, що отримали назву рібофоріни, які специфічно з'єднуються з сигнальної послідовністю поліпептиду. Це приєднання має більш складний характер. Виявилося, що в цитоплазмі присутні спеціальні сігналузнающіе структури (СВР), що представляють собою 11S рибонуклепротеіну. Вони взаємодіють з сигнальної послідовністю зростаючого поліпептиду, при цьому елонгація тимчасово припиняється. Синтезується поліпептид з СУС приєднується до рібофорінам в мембрані ЕР; при цьому утворюється мембранний канал, який іноді називають транслоконом. Елонгація відновлюється, але тепер вона пов'язана з переміщенням пептиду через мембрану ЕР. Після завершення синтезу поліпептидного ланцюга йод дією протеази, яка носить назву сігналаза, сигнальна послідовність відщеплюється, а новосін- тезірованний білок піддається посттрансляційних модифікаціям або процесингу. Для більшості секреторних і мембранних білків процесинг пов'язаний з транспортом через певні компартменти. Так, глікозілі- рованіс і обмежений протеоліз починаються вже в ЕР і тривають в апараті Гольджі. Цей компартмент складається з 12-15 «тарілок», складених в стопку. Сторона, орієнтована на ЕР, називається цис-стороною, а в напрямку цитоплазматичної мембрани - транс-стороною. Новосінтезі- рова білки надходять на щ / с-сторону апарату Гольджі і переміщаються на його транс-сторону, перетинаючи все тарілки, причому в міру руху відбувається їх хімічна модифікація. Ця модифікація має величезне значення, так як вона, зокрема, визначає проходження новосинтезованого білка до місця функціонування. Так, фосфорильовані в певному положенні білки йдуть в лізосоми, глікозильовані білки, в залежності від сайту глікозилювання і розмірів вуглеводної ланцюги, можуть вбудовуватися в мембрани або експортуватися в інші тканини і органи. Крім того, хімічна модифікація визначає властивості зрілих білків. Апарат Гольджі є своєрідним сортувальних депо, що відокремлює нормальні білки від дефектних. Останні переміщаються в лізосоми, асоційовані з апаратом Гольджі, де гідролізуються до амінокислот. Нормальні білки доходять до транс-боку і потрапляють в секреторні гранули, які відділяються від апарату Гольджі і дифундують до цитоплазматичної мембрани. Потім методом екзоцитозу білки потрапляють в позаклітинний простір.
Внутрішньоклітинні білки синтезуються на вільних рибосомах. Вони нс мають сигнальних послідовностей, проте в більшості своїй синтезуються у вигляді пробелкой. Деякі з них після відповідного процесингу функціонують в цитоплазмі, інші імпортують у внутрішньоклітинні органели. Крім адресному модифікації, існують різноманітні хімічні модифікації і локальний протеоліз білків, необхідні для їх повноцінного функціонування. Такими модифікаціями можуть бути фосфорилирование по гідроксильних груп амінокислот, метилювання, гідроксилювання, приєднання карбоксильних, сульфо- і ацетильних груп і ін.