| Головна |
| «« | ЗМІСТ | »» |
|---|
рекомбінантна ДНК - це штучно отримана ДНК, яка включає ген (гени), що є об'єктом генетичних маніпуляцій, і вектор, що забезпечує розмноження рекомбінантної ДНК і синтез в клітці господаря певного продукту, кодованого внесеним геном.
Вектори повинні володіти такими особливостями:
Конструювання рекомбінантних молекул ДНК почалося з отримання гібридних ДНК між плазмідами. У 1978 р М. Коєном був прознавств експеримент, в якому вдалося створити нову гібридну плазміду, що об'єднала стійкість до антибіотиків, якою володіли молекули ДНК об'єднуються плазмід.
Схема отримання рекомбінантної плазміди і її клонування в клітинах бактерій приведена на рис. 15.13.
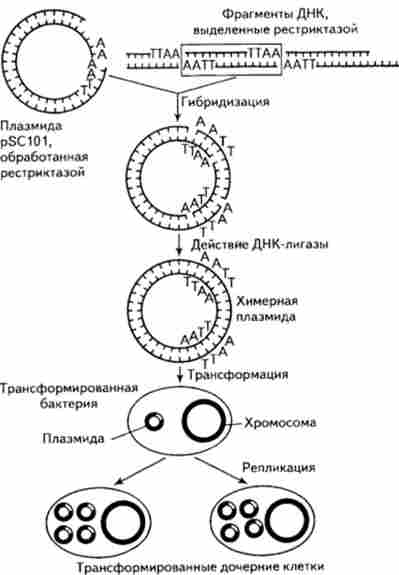
Мал. 15.13. Отримання рекомбінантних плазміди і її клонування в клітинах бактерій
Отримано численні факти перенесення генів з клітин еукаріот в клітини бактерій. Дж. Морроу і його співробітники (1974) використовували в якості вектора ДНК плазміди pSClOl Е. coli і в якості переносного ген-специфічного матеріалу - фрагмент ДНК з хромосоми африканської шпорцевой жаби (Xenopus laevis), Який кодує синтез молекул рибо сомной ДНК.
Фрагменти ДНК, що детермінують синтез молекул рРНК (фрагменти РДНК), «пришивались» до плазмиде. Потім гібридними молекулами трансформували Е. coli за ознакою стійкості до тетрацикліну. З клітин трансформантов виділяли плазмидную ДНК, вивчали її в градієнті щільності хлористого цезію, під електронним мікроскопом перевіряли її здатність до гібридизації з міченої Хвороби X laevis і досліджували, на яке число фрагментів вона розпадається під дією рестриктаз. Всі тести показали наявність генетичного матеріалу X. laevis в плазмидах, здатних до реплікації в клітинах бактерії. Крім того, була досліджена здатність цього матеріалу, включеного в ДНК плазміди, до транскрипції. Для цієї мети були використані так звані мініклеткі, т. Е. Бактеріальні клітини одного з мутантів, що не містять в певних умовах ДНК. Досліди показали, що в міні-клітинах, трансформованих рекомбінантними плазмідами, здійснюється транскрипція генів з ДНК X. 1аеук.
У наступні роки ряд генів людини був взнавств в клітини бактерій, за допомогою яких синтезували необхідні білки людини (рис. 15.14).
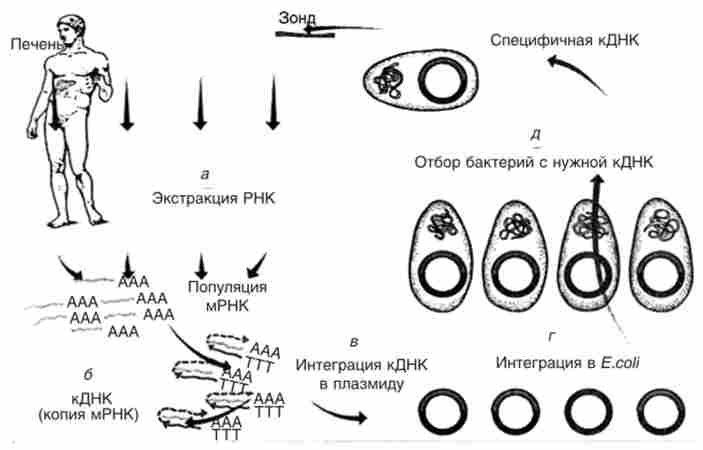
Мал. 15.14. Основні етапи виробництва білка методами генної інженерії: а - екстракція мРНК певного гена; б - копіювання екстрагованої мРНК в кДНК ферментом ревертазой; в - інтеграція кДНК в відповідний вектор, зазвичай плазмиду; г - введення рекомбінантних плазмід в клітини бактерії Е. coir, д - виділення з популяції трансформованих бактерій клону з потрібною кДНК для продукування відповідного білка
Безпосереднє клонування геномної ДНК все ще залишається технічно важким завданням. Експериментатор, бажаючи підкреслити будь-якої ген, має в своєму розпорядженні для початку трьома джерелами: білками, мРНК і геномної ДНК. Основою поки залишається процедура, що дозволяє по мРНК відтворювати ДНК.
Як приклад розглянемо клонування генів факторів крові. Сначапа знаходять орган, в якому виділяється ген експресується найактивніше, т. Е. Рівень відповідної мРНК в ньому найвищий.
Після екстракції мРНК з такої тканини приступають до отримання з мРНК ДНК-копій (комплементарної ДНК, або кДНК) за допомогою зворотної транскриптази. Комплементарна ДНК набагато стабільніша, ніж відповідна мРНК. Крім того, в двухцепочечную вигляді її можна інтегрувати в плазміду (бактеріальну міні-хромосому), яку в свою чергу вводять в бактерію типу Е. coli. Такі плазміди, які використовуються зараз у всіх лабораторіях, де проводять роботи з генної інженерії, походять від дикого типу і несуть в більшості своїй по два гена стійкості до антибіотиків (наприклад, до пеніциліну і тетрацикліну). Ці маркери дозволяють відбирати ті бактерії, які містять плазміду, а серед них в свою чергу ті, у яких плазмида включила в себе кДНК. Оскільки кДНК вбудовується всередину гена стійкості до пеніциліну, такий «роздроблений» ген вже не працює, і бактерії знову знаходять чутливість до антибіотика. Стійкість ж до тетрацикліну при цьому зберігається. Отже, досить висіяти бактерії на живильне середовище з тетрацикліном, щоб відібрати з них містять плазміду, а потім з останніх - містять так звану рекомбинантную плазмиду і чутливі до пеніциліну. Таким чином і отримують відповідний «банк кДНК».
Наступний етап полягає в тому, щоб серед 104-105 незалежних бактеріальних колоній визначити ті, які містять генетичну інформацію про цікавить нас гені незгортання крові.
Для того щоб серед десятків тисяч бактеріальних колоній банку кДНК знайти ту, яка містить кДНК потрібного білка, доводиться використовувати різні способи, т. К. Жоден з них окремо не гарантує успіху. Один з цих методів полягає у використанні синтетичного зонда, гомологичного потрібної молекулі кДНК. Такий мічений зонд гібрідізіруют з кДНК, так що мітка вводиться на всю колонію. Розроблено також кілька спрощених методик, що використовують ту чи іншу апріорну інформацію.
Припустимо, що відомі лише фрагменти амінокислотноїпослідовності цього білка. Знаючи генетичний код, хімік може синтезувати відповідні їм фрагменти ДНК завдовжки 14-18 п. Н. Помітивши їх радіоактивним фосфором 32Р, біолог може скористатися ними як молекулярним зондом для виявлення тих бактеріальних клонів, які містять відповідну кДНК. Метод грунтується на тому, що кДНК гомологічних послідовностей здатні зв'язуватися один з одним. Колонію з кДНК, гомологичной будь-якого з мічених фрагментів, тепер легко визначити після відповідної експозиції фотоплівки.
За останні роки ця методика була суттєво вдосконалена багато в чому завдяки успіхам в хімічному синтезі ДНК.
Отримання кДНК людини можливо в два етапи: після виділення гомологичной кДНК якої-небудь тварини її вже можна використовувати в якості зонда. Дві молекули кДНК, наприклад миші і людини, здатні з'єднуватися так само ефективно, як і в разі двох близькоспоріднених ссавців.
Ситуація ускладнюється, якщо амінокислотна послідовність не відома. Методика дослідження в цьому випадку зводиться до того, щоб змусити бактерії безпосередньо зчитувати міститься кДНК, потім виявляти такі колонії специфічними антитілами.
Здатність кДНК зв'язуватися з мРНК також знайшла застосування. Після гібридизації кожну мРНК елюіруют (осаджують за допомогою електрофорезу), потім з неї зчитують білок або вбезклітинних системі, або (після ін'єкції) в яйцеклітині земноводного. Білок характеризують по його молекулярною властивостями і біологічною активністю.
Вчені розробляють нові методи, що прискорюють виділення клонів. Стало очевидним, що при виділенні клонів слід використовувати різні способи одночасно. При такому підході потрібний клон кДНК завжди можна буде виділити.
Після клонування починається «експлуатація» кДНК. Її докладне дослідження дозволяє швидко визначити первинну структуру відповідного білка. У більшості випадків кДНК безпосередньо використовують для виробництва «свого білка». Але можна її замінити, скористатися нею для виділення самого гена з банку геномної ДНК (методом гібридизації). Вивчення самих генів дозволяє краще зрозуміти їх структуру та механізми дії в організмі.