| Головна |
| «« | ЗМІСТ | »» |
|---|
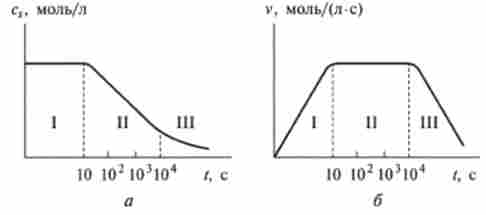
Якщо зобразити кінетичні перетворення субстрату в присутності ферменту у вигляді кривої, то можна виділити три ділянки: I, II і III (рис. 11.1,6). На початкова ділянка I доводиться лише незначна частина загального часу протікання реакції, порядку декількох мілісекунд. Ця ділянка називається перехідним: тут швидкість змінюється від нуля до деякого значення vCT.

Мал. II.I. Кінетика ферментативної реакції: а - кінетична крива субстрату б - швидкість убутку субстрату
На ділянці II швидкість залишається приблизно постійною, рівною vCT протягом декількох хвилин. Частина II називається стаціонарним, йому відповідає приблизно прямолінійний відрізок кінетичної кривої.
На ділянці III швидкість перетворення субстрату монотонно падає до нуля внаслідок витрати субстрату. На цю ділянку доводиться найбільша частина часу протікання реакції, порядку декількох десятків хвилин, в зв'язку з чим ділянку III називається основним.
Загальна форма кінетичної кривої (рис. 11.1, а), яка описує ферментативний каталіз, має S-подібний характер, типовий для реакцій послідовного перетворення (див. Рис. 10.4). Така схожість наводить на думку, що в ході ферментативної реакції субстрат утворює певний проміжний продукт - интермедиат.
Вивчення кінетики різних ферментативних реакцій підтверджує висловлене припущення. У всіх ферментативних реакціях субстрат S утворює з молекулою ферменту Е з'єднання ES, яке називається фермент-субстратним комплексом. Фермснт-субстратної комплекс може розпадатися по двох шляхах. При розпаді по одному шляху знову утворюється вихідна молекула субстрату і ферменту Е. При розпаді іншим шляхом утворюється молекула продукту Р і регенерується молекула ферменту Е.
Таким чином, механізм ферментного каталізу описується наступними стадіями:
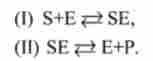
Суворі експериментальні докази розглянутого механізму дії ферментів вперше отримали Л. Міхаеліс та М. Ментен (1913). Ці ж вчені вивели формулу залежності стаціонарної швидкості vCT ферментативної реакції від концентрації субстрату (рівняння Міхаеліса-Ментен):

де cs - концентрація субстрату на початку ділянки II кінетичної кривої (рис. 11.1, а / Гм і См - постійні для даних ферменту і субстрату величини.
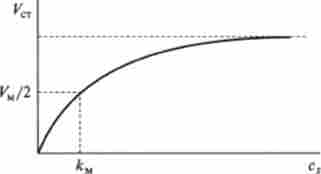
Мал. 11.2. Графік залежності стаціонарної швидкості vCT ферментативної реакції від концентрації субстрату
Графічно залежність стаціонарної швидкості Уст від концентрації субстрату cs зображена на рис. 11.2. Особливості цієї залежності можна встановити наступним чином.
При малих концентраціях субстрату, коли виконується нерівність cs«/ Cm, величиною cs в знаменнику вираження (11.1) можна знехтувати. Залежність стаціонарної швидкості vCT від cs набирає вигляду
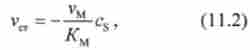
т. е. величина vCT пропорційна концентрації cs-
Відповідно до таким характером залежності початкова ділянка графіка при малих концентраціях субстрату являє собою пряму лінію з тангенсом нахилу, рівним vM.
При великих концентраціях субстрату, коли виконується нерівність cs»KM, в знаменнику вираження (11.1) можна знехтувати величиною В цьому випадку залежність (9.38) перетвориться до виду

З виразу (11.3) випливає, що при великих концентраціях субстрату швидкість досягає максимального значення vM і не залежить від величини з $. Відповідно ділянку графіка рис. 11.2 при великих значеннях з являє собою пряму, паралельну осі абсцис.
Якщо для деякого ферменту експериментально вивчена залежність стаціонарної швидкості Уст ферментного перетворення даного субстрату від концентрації цього субстрату (рис. 11.2), неважко визначити числові значення постійних км і vM.
величина vM, як це було показано вище, дорівнює максимально можливої швидкості перетворення субстрату при даній концентрації ферменту.
Величина / См, як випливає з виразу (11.1), чисельно дорівнює такій концентрації субстрату, при якій стаціонарна швидкість дорівнює половині максимальної. Ця величина називається константою Міхаеліса.
Спостережувану концентрационную залежність стаціонарної швидкості vCT ферментативної реакції неважко пояснити, виходячи з механізму ферментного каталізу.
Очевидно, що швидкість перетворення субстрату з утворенням продукту Р пропорційна концентрації фермент-субстратного комплексу Р (стадія II).
При малих концентраціях субстрату в розчині є деяка кількість вільних молекул ферменту Е, не пов'язаних в комплекс SE. Тому при збільшенні концентрації субстрату концентрація комплексів зростає (стадія I) і відповідно зростає швидкість реакції.
При великих концентраціях субстрату практично всі молекули ферменту пов'язані в комплекси SE. Тому подальше збільшення концентрації субстрату практично не збільшує концентрацію комплексів і, отже, швидкість реакції залишається постійною.
Освіта фермент-субстратні комплексів дозволяє пояснити також зниження енергії активації перетворення субстрату. Зв'язування в комплекс призводить до перерозподілу електронів в молекулі субстрату, що, в свою чергу, зменшує міцність розриваються зв'язків і відповідно енергію активації.
Розглянуті в даному розділі приклади наочно показують, як на основі кінетичних закономірностей із залученням термодинаміки можна прогнозувати перебіг у часі хімічних реакцій, в тому числі і таких складних, як біохімічні перетворення.
Питання і завдання до гл. 10,11