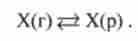
| Головна |
| «« | ЗМІСТ | »» |
|---|
Розчинення газів в рідинах майже завжди супроводжується виділенням теплоти (ентальпія ДЯраств
Іноді розчинення газу супроводжується поглинанням теплоти, наприклад розчинення благородних газів в деяких органічних розчинниках. У цьому випадку підвищення температури збільшує розчинність газу.
Газ, як і багато інших речовин, що не розчиняється в рідині безмежно. 11ри деякої концентрації газу X встановлюється рівновага:
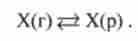
11ри розчиненні газу в рідині відбувається значне зменшення обсягу системи. Тому підвищення тиску, відповідно до принципу Ле Шательє, повинно призводити до зміщення рівноваги вправо, т. Е. До збільшення розчинності газу. Якщо газ малорастворим в даній рідини і тиск невеликий, то розчинність газу пропорційна його тиску. Ця залежність виражається законом Генрі (1803):
Кількість газу, розчиненого при даній температурі в певному об'ємі рідини, при рівновазі прямо пропорційно тиску газу.
Закон Генрі може бути записаний в такій формі:

де з (X) - концентрація газу в насиченому розчині, моль / л; р (X) - тиск газу X над розчином, Па; Яг (X) - постійна Генрі для газу X, моль-л '- Па 1 .
Константа Генрі залежить від природи газу, розчинника і температури. У табл. 8.3 представлені константи Генрі для деяких газів, розчинених у воді, при 298 К.
Закон Генрі справедливий лише для порівняно розбавлених розчинів, при невисоких тисках і відсутності хімічної взаємодії між молекулами розчиняється газу і розчинника. Так, СО2 і NH3 вступають в хімічну взаємодію з водою, а АЛЕ дисоціює в воді, що різко підвищує розчинність цих газів. При дуже високих тисках розчинність газу може досягти максимуму, оскільки в цьому випадку зміна обсягу рідини внаслідок розчинення в ній газу стає таким же об'ємом розчиненого газу.
Таблиця 8.3
Константи Генрі для газів, розчинених у воді (298 К)
|
газ |
А | (Х). моль-л '1НІА'1 |
газ |
А | (Х), моль-л'-НІА'1 |
|
м2 |
6,13 |
н2 |
7,53 |
|
про2 |
12,8 |
Нс |
3.73 |
|
зі2 |
337 |
Аг |
14,9 |
Закон Генрі є окремим випадком загального закону Дальтона. Якщо мова йде про розчиненні не одного газоподібної речовини, а суміші газів, то розчинність кожного компонента підпорядковується закону Дальтона:
Розчинність кожного з компонентів газової суміші при постійній температурі пропорційна парціальному тиску компонента над рідиною і не залежить від загального тиску суміші і індивідуальних властивостей інших компонентів.
Інакше кажучи, в разі розчинення суміші газів в рідині в математичний вираз закону Генрі (8.1) замість р (X) підставляють парціальний тиск р, даного компонента.
Під парціальним тиском р, компонента розуміють частину загального тиску Ровш газової суміші, яка обумовлена цим компонентом:
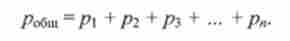
Приклад. Повітря являє собою суміш, що складається в основному з трьох газів: 78% азоту, 21% кисню і 1% аргону (за обсягом). Визначте концентрацію азоту в воді при 298 К, якщо постійна Генрі дорівнює 6,13 * 10 4 моль-л '-па.
Так як повітря містить 78% азоту за обсягом, парціальний тиск азоту в повітрі при 101 325 Па становить 79 033,5 Па (об'ємна частка азоту дорівнює молярної частки азоту, звідси р (иг) =АбщО, 78). Із закону Дальтона випливає, що c (N2) = * KN2) * Р (М2), Звідси c (N2) = 6,13-10 ~9-79 033,5 = 4,84-10 ^ моль / л.
Вивчаючи розчинність газів в рідинах в присутності електролітів, російський лікар-фізіолог І. М. Сєченов (1829-1905) встановив таку закономірність (Закон Сеченова):
Розчинність газів в рідинах в присутності електролітів знижується; відбувається висолювання газів.
Математичне вираження закону Сеченова має наступний вигляд:

де с (Х) - розчинність газу X в присутності електроліту; зі (X) - розчинність газу X в чистому розчиннику; зе - концентрація електроліту; Доз - константа Сеченова, що залежить від природи газу, електроліту і температури.
Однією з причин, яка призводить до зменшення розчинності газів в присутності електролітів, є гідратація (сольватация) іонів електролітів молекулами розчинника. В результаті цього процесу зменшується число вільних молекул розчинника, а отже, знижується нею растворяющая здатність.
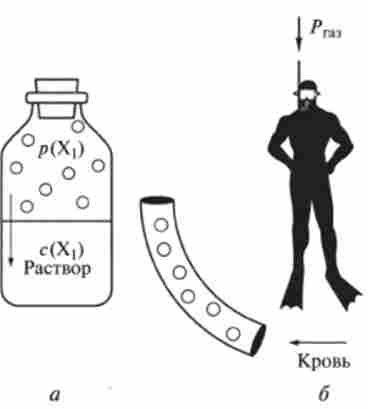
Мал. 8.2. Роль закону Генрі в життєдіяльності:
а - розчинення газу в рідині. б - розчинення газу в крові; р (Х |) - парцналь- ніс тиск речовини Х | в газі, з (Х |) - кон- центрація ттого речовини в розчині. Рт - тиск газової дихальної суміші