| Головна |
| «« | ЗМІСТ | »» |
|---|
На основі генно-інженерних методів можна конструювати мікробні клітини, здатні синтезувати структури рослинного і тваринного походження, що мають важливе значення для медицини і промисловості.
Інсулін грає основну роль в лікуванні діабету - хвороби, за поширеністю займає третє місце після серцево-судинних захворювань і раку. Отримання цього гормону генно-інженерних способом видавалося вельми перспективним і було виконано на початку 80-х рр. XX століття. Як компетентної клітини використовували Е. coli, гени обох ланцюгів молекули людського інсуліну були отримані методом хімічного синтезу. Ці гени приєднували до -кінцю гена, що кодує білок р-галакто- зідазу, і вводили в векторну плазміду. трансформовані клітини Е. coli
синтезували химерні білки, що складаються з А- або В-ланцюга інсуліну, приєднаної через метіонін до р-галактозілазс. За допомогою бромціан, специфічно розщеплює білки по залишку метіоніну, виділяли індивідуальну ланцюг інсуліну. Далі ланцюга з'єднували в єдину активну молекулу інсуліну. Освіта дисульфідних ланцюгів in vitro стало лимитирующей стадією всього процесу, причому вихід був незначним. У зв'язку з цим був розроблений метод отримання проінсуліну людини з подальшим дозріванням його in vitro. Були синтезовані кілька десятків олігонуклеотидів, з'єднаних потім за допомогою ДНК-лігази. Отримані дволанцюжкові фрагменти ДНК, що відповідають гену, що кодує людський інсулін, були вбудовані в плазміду, а потім перенесені в Е. зі // (рис. 31.5).
Отримані рекомбінантні клітини синтезували проінсулін, який потім in vitro перетворювали в зрілий інсулін. В даний час генно-інженерний інсулін широко застосовується в медичній практиці.
Соматотропін - гормон росту - грає істотну роль в постнатальному розвитку організму, контролюючи багато сторін вуглеводного, ліпідного і мінерального обмінів. Дефіцит гормону призводить до карликовості, лікування якої проводиться за допомогою соматотропінотерапіі. На відміну від інсуліну соматотропін володіє видовою специфічністю, і до недавнього часу його виділяли з гіпофіза трупів. Виражена гетерогенність цього гормону негативно позначалася на його фармакологічній ефекті. Отримання генно-інженерного соматотропіну стало вирішенням проблеми забезпечення медицини цим препаратом.
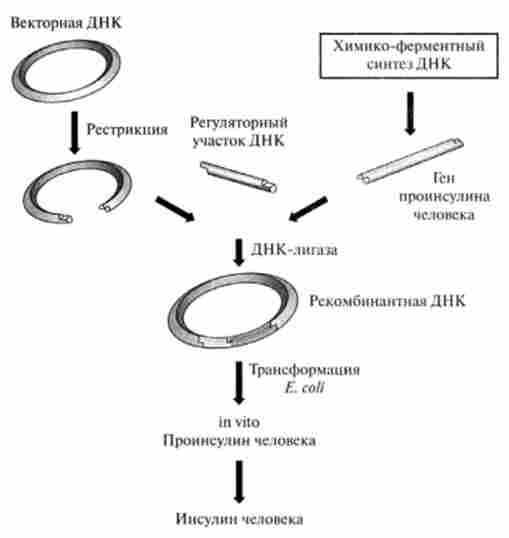
Мал. 31.5. Отримання інсуліну людини генно-інженерних метолом (по В. А. Єфімова)
Процедура отримання генно-інженерного гормону проводилася з урахуванням того, що просоматотропін нс піддається процесингу в бактеріальної клітці. Був використаний комбінований метод отримання гена соматотро- Піна. Фрагмент ДНК, що кодує перші 23 амінокислотних залишку з N-кінця, був отриманий методом хіміко-ферментативного синтезу, а олигонуклеотид, що кодує інші амінокислотні залишки гормону, представляв собою кДНК, отриману за допомогою зворотної транскриптази на матриці мРНК. Потім обидва фрагмента об'єднували в одній плазмиде і переносили в Е. coli. Утворений гормон володів біологічною активністю, порівнянної з гіпофізарний соматотропином.
Інтерфероіи - низькомолекулярні білки, що володіють виражену противірусну активність. Крім того, інтерферони проявляють фармакологічний ефект при таких захворюваннях, як гепатит В, розсіяний склероз, деякі локалізації пухлин. Розрізняють три класи інтерферо- новий за місцем їх синтезу в клітинах людини і тварин: а-інтерферон з лейкоцитів, p-інтерфсрон з фібробластів і у-інтерферон з тимуса, а-Інтерферон є простим білком, р- і у-білки - глікозовані. Інтерферон є одним з найефективніших засобів лікування вірусних інфекцій, але він видоспецифичен і може бути отриманий тільки з клітин людини. Технологія виділення та очищення інтерферонів малоефективна насамперед через вкрай малого виходу кінцевого продукту. Тому отримання генно інженерного продукту є перспективною альтернативою традиційним методам виділення інтерферону.
Вперше ген інтерферону був взнавств в бактеріальну клітину Е. eoli близько 20 років тому, і в наступні роки техніка генно-інженерних процедур постійно вдосконалювалася. Лейкоцитарний інтерферон був отриманий на основі трансформованих клітин Е. coli наступним чином. Ген інтерферону отримували хіміко-ферментативним методом. Однією з труднощів, яку довелося подолати, було те, що інтерферон синтезується у вигляді попередника з додатковою (сигнальної) послідовністю амінокислотних залишків. Бактеріальні клітини нс мають протеїназ, що перетворюють попередники в зрілі білки, тому треба було синтезувати ген, що кодує тільки зрілий інтерферон. Такий ген зрештою був отриманий і взнавств в клітку?. coli. Рекомбінантний штам синтезував у великих кількостях інтерферон, що володіє вираженою біологічною активністю. Значною подією стала вдала спроба введення гена інтерферону в дріжджові клітини. Ген, який кодує інтерферон, був отриманий за допомогою мРНК і зворотної транскриптази. кДНК а-інтерферону з'єднали з олігонуклеотидів, що кодує алкогольдегідрогеназу дріжджів і вбудували в плазміду. Плазміду, навантажену чужорідними генами, ввели в дріжджову клітину Saccharomyces cerevisiae. Заміна промотора гена людського інтерферону на ген дріжджовий алкогольдегідрогенази забезпечила ефективну експресію гена інтерферону. Заміна бактеріальної клітини в якості реципієнта на дріжджову зіграла величезну роль для всієї генно інженерної техніки взагалі і для отримання інтерферонів зокрема. Справа в тому, що р- і у-інтерферони є глікозильовані білки, а процес глікозилювання неможливий в Е. coli, але цілком здійснимо в дріжджовий клітці.