| Головна |
| «« | ЗМІСТ | »» |
|---|
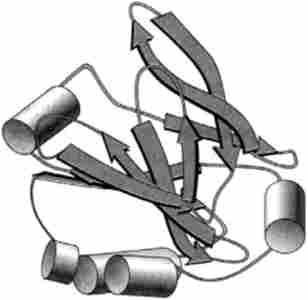
Мал. 3.9. Третинна структура лактоглобуліну - типового а / р-білка (по PDB-200I) (Brownlow, S., Marais Cabral, JH, Cooper, R., Flower, DR, Yewdall, SJ, Polikarpov, I., North, AC, Sawyer , L .: Structure, 5, p. 481. 1997)
Просторова структура залежить не від довжини поліпептидного ланцюга, а від послідовності амінокислотних залишків, специфічною для кожного білка, а також від бічних радикалів, властивих відповідним амінокислотам. Просторову тривимірну структуру або конформацию білкових макромолекул утворюють в першу чергу водневі зв'язку, а також гідрофобні взаємодії між неполярними бічними радикалами амінокислот. Водневі зв'язки відіграють величезну роль у формуванні та підтримці просторової структури білкової макромолекули. Воднева зв'язок утворюється між двома електронегативними атомами за допомогою протона водню, ковалентно зв'язаного з одним з цих атомів. Коли єдиний електрон атома водню бере участь в утворенні електронної пари, то протон притягається сусіднім атомом, утворюючи водневий зв'язок. Обов'язковою умовою утворення водневого зв'язку є наявність хоча б однієї вільної пари електронів у електронегативного атома. Що стосується гідрофобних взаємодій, то вони виникають в результаті контакту між неполярними радикалами, нездатними розірвати водневі зв'язки між молекулами води, яка витісняється на поверхню білкової глобули. У міру синтезу білка неполярні хімічні угруповання збираються всередині глобули, а полярні витісняються на її поверхню. Таким чином, білкова молекула може бути нейтральною, зарядженої позитивно або ж негативно залежно від pH розчинника і йоногенних груп в білку. До слабких взаємодій відносять також іонні зв'язку і ван-дер-ваальсові взаємодії. Крім того, конформація білків підтримується ковалентними зв'язками S-S, що утворюються між двома залишками цистеїну. В результаті гідрофобних і гідрофільних взаємодій молекула білка спонтанно приймає одну або декілька найбільш термодинамічно вигідних конформацій, причому, якщо в результаті яких-небудь зовнішніх впливів нативная конформація порушується, можливе повне або майже повне її відновлення. Вперше це показав К. Анфінсен на прикладі каталитично активного білка рибонуклеази. Виявилося, що при впливі сечовиною або p-меркаптоетанолом відбувається зміна її конформації і, як наслідок, різке зниження каталітичної активності. Видалення сечовини призводить до переходу конформації білка в початковий стан, і каталітична активність відновлюється.
Таким чином, конформація білків є тривимірну структуру, причому в результаті її освіти багато атоми, що знаходяться на віддалених ділянках поліпептидного ланцюга, зближуються і, впливаючи один на одного, набувають нових властивостей, які відсутні у індивідуальних амінокислот або невеликих поліпептидів. Це так звана третинна структура, що характеризується орієнтацією поліпептидних ланцюгів в просторі (рис. 3.9). Третинна структура глобулярних і фібрилярних білків істотно відрізняється друг від друга. Прийнято форму білкової молекули характеризувати таким показником, як ступінь асиметрії (відношення довгої осі молекули до короткої). У глобулярних білків ступінь асиметрії дорівнює 3-5, що стосується фібрилярних білків, то ця величина у них набагато більше (від 80 до 150).
Яким же чином первинна і вторинна розгорнуті структури перетворюються в згорнуту, вельми стабільну форму? Розрахунки показують, що число теоретично можливих комбінацій освіти тривимірних структур білків незмірно більше, ніж реально існуючих в природі. Мабуть, основним чинником конформационной стабільності є енергетично найвигідніші форми.
Гіпотеза розплавленої глобули. Одним із способів вивчення згортання поліпептидного ланцюга в тривимірну структуру є денатурація і подальша рснатурація білкової молекули.
Досліди К. Анфінсен з рібонуклеазою однозначно показують можливість збірки саме тієї просторової структури, яка була порушена в результаті денатурації (рис. 3.10).
В даному випадку відновлення нативної конформації не вимагає наявності жодних додаткових структур. Які ж моделі згортання поліпептидного ланцюга в відповідну конформацию є найбільш ймовірними? Однією з поширених гіпотез самоорганізації білка є гіпотеза розплавленої глобули. В рамках цієї концепції виділяють кілька етапів самозборки білків.
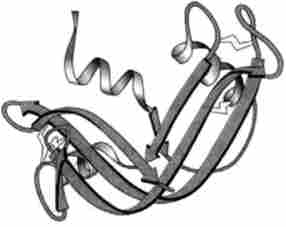
Мал. 3.10. Нативная структура рібонуклсази
значно збільшується. Характерною особливістю цієї стадії є утворення специфічних контактів між атомами, що знаходяться на віддалених ділянках поліпептидного ланцюга, але опинилися зближеними в результаті утворення третинної структури.
3. На останньому етапі формується нативная конформація білкової молекули, пов'язана з замиканням дисульфідних зв'язків та остаточної стабілізацією білкової конформації. Не виключена також неспецифічна агрегація частково зверну
тих поліпсптідних ланцюгів, що можна кваліфікувати як помилки освіти нативних білків. Частково згорнута поліпептидний ланцюг (етап 2) називається розплавленої глобули, а етап 3 є найповільнішим при утворенні зрілого білка.
На рис. 3.11 показаний варіант утворення білкової макромолекули, кодируемой одним геном. Відомо, однак, що ряд білків, що мають домен-
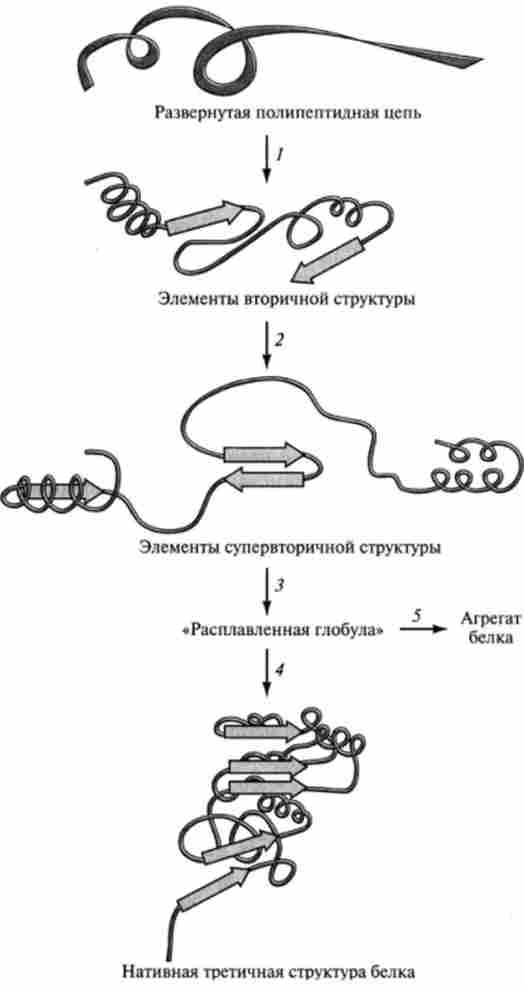
Мал. 3.11. Етапи згортання поліпептидного ланцюга в нативну конформацію білка
(По Н. К. Наградова) ву структуру, формується в результаті дублікації генів, і освіту контактів між окремими доменами вимагає додаткових зусиль. Виявилося, що в клітинах є спеціальні механізми регуляції процесів згортання новосінтезіро- ванних білків. В даний час виявлено два ферменти, що беруть участь в реалізації цих механізмів. Однією з повільних реакцій третього етапу згортання поліпептидних ланцюгів є * мс / т /? ш / з-ізомеризація пептидного зв'язку, що передує залишку проліну. Незважаючи на те що трш / с-конформація в поліпептидного ланцюга є переважаючою, приблизно 7% зв'язків, утворених залишками проліну, знаходяться в щ / с-конформації. Ця реакція, яка веде до повороту ланцюга на 180е, в клітинах каталізується за допомогою ферменту пептіліл-про- лив-лисиць / т / ШНС-ізомерази. Другим ферментом, що каталізує утворення і ізомеризації дисульфідних зв'язків, є протеіндісульфілізомераза. до функцій якої входить також розщеплення неправильно утворених ли сульфідних містків.

Мал. 3.12. Третинна структура шаперона hsp70 (no PDB-2001) (Prodronwu, С., Roe, S. М., O'Brien, R., Ladbury, JE. Piper, PW, Pearl, L., Hne., Cell, 90, p. 65, 1997)
Крім того, в клітинах є ряд каталитично неактивних білків, які тим не менше роблять великий внесок в освіту просторових структур білків. Це так звані шаперони і шапероніну (рис. 3.12). Один з першовідкривачів молекулярних шаперонов, Л. Елліс, називає їх функціональним класом не пов'язаних один з одним сімейств білків, які допомагають правильній Нековалентні збірці інших поліпептідсодержа- ших структур in vivo, але не входять до складу зібраних структур і не беруть участь в реалізації їх нормальних фізіологічних функцій.
Шаперони допомагають правильній збірці тривимірної білкової конформації шляхом утворення оборотних нековалентних комплексів з частково згорнутої поліпептидного ланцюгом, одночасно пригнічуючи неправильно утворені зв'язку, що ведуть до формування функціонально неактивних білкових структур. У перелік функцій, властивих шаперон, входить захист розплавлених глобул від агрегації, а також перенесення новосинтезованих білків в різні локуси клітин. Шаперони переважно є білками теплового шоку, синтез яких різко посилюється при стресовому температурному впливі, тому їх називають ще hsp (heat shock proteins). Сімейства цих білків знайдені в мікробних, рослинних і тваринних клітинах. Класифікація шаперонов заснована на їх молекулярній масі, яка варіює від 10 до 90 kDa. В основному функції шаперонов і шаперо- Нінов розрізняються, хоча і ті, і інші є білками-помічниками процесів утворення тривимірної структури білків. Шаперони утримують новосінтсзірованную поліпептидний ланцюг в розгорнутому стані, не даючи їй згорнутися в відмінну від нативної форму, а шапероніну забезпечують умови для утворення єдиної правильної, нативной структури білка (рис. 3.13).
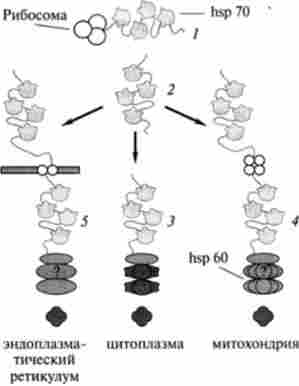
Мал. 3.13. Участь шаперонов і шаперонінів в згортанні білка в цитоплазмі клітин еукаріот (по Н. К. Нагород про виття)
Шаперони / пов'язані з нансцентной поліпептидного ланцюгом, що сходить з рибосоми. Після утворення поліпептидного ланцюга і виходу її з рибосоми шаперони з'єднуються з нею і перешкоджають агрегації 2. Після згортання в цитоплазмі білки відділяються від шаперона і переходять на відповідний шаперо- нин, де і відбувається остаточне освіту третинної структури 3. За допомогою цитозольного шаперона білки переміщаються до зовнішньої мембрані мітохондрії, де мітохондріальний шапе- рон простягає їх всередину мітохондрій і «передає» мітохондріального шапероніну, де і відбувається згортання 4, а 5 аналогічно 4, але стосовно до ендоплазматичнийретикулум.