| Головна |
| «« | ЗМІСТ | »» |
|---|
Пептидні ланцюги білків організовані у вторинну структуру, стабілізовану водневими зв'язками. Атом кисню кожної пептидного групи утворює при цьому водневий зв'язок з NH-групою, що відповідає пептидного зв'язку. При цьому формуються такі структури: а-спіраль, структура і р-вигин.
а-Спіраль. Однією з найбільш термодинамічно вигідних структур є права а-спіраль. На рис. 3.1 зображена а-спіраль, що представляє стійку структуру, в якій кожна карбонильная група утворює водневий зв'язок з четвертої по ходу ланцюга NH-групою. У а-спіралі на один її виток припадає 3,6 амінокислотного залишку, крок спіралі складає приблизно 0,54 нм, а відстань між залишками - 0,15 нм. У а-спіральних ділянках торсіонні кути ф і у рівні 60 і 45е і послідовно розташовані поліпептидні ланки взаємно орієнтовані.
L-Амінокислоти можуть утворювати лише праві а-спіралі, причому бічні радикали розташовані по обидва боки осі і звернені назовні. У а-спіралі повністю використана можливість утворення водневих зв'язків, тому вона не здатна на відміну від p-структури утворювати водневі зв'язки з іншими елементами вторинної структури. При утворенні а-спіралі бічні ланцюга амінокислот можуть зближуватися, утворюючи гідрофобні або гідрофільні компактні сайти. Ці сайти відіграють істотну роль при утворенні тривимірної конформації білкової макромолекули, так як використовуються для упаковки а-спіралей в просторову структуру білка.
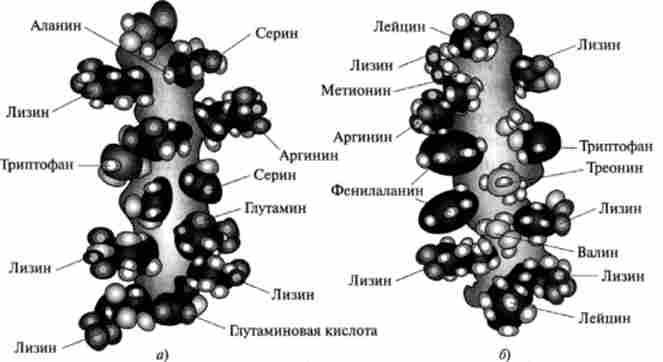
Мал. 3.1. а-Спіраль білка аполіпопротсіна С-1 (але В. М. Степанову): а - гидрофильная поверхню: б - гідрофобна поверхня а-спіралі білка
Спіраль-клубок. Зміст а-спіралсй в білках неоднаково і є індивідуальною особливістю кожної білкової макромолекули. Для деяких білків, наприклад для міоглобіну, а-спіраль лежить в основі структури, інші, наприклад хімотрипсин, не мають а-спіраль ділянок. В середньому глобулярні білки мають ступінь спирализации близько 60-70%. Спіраль ділянки чергуються з хаотичними клубками, причому в результаті денатурації переходи спіраль-клубок збільшуються. Спирализация поліпептидного ланцюга залежить від амінокислотних залишків, що її утворюють. Так, негативно заряджені групи глутамінової кислоти, розташовані в безпосередній близькості один від одного, відчувають сильне взаємне відштовхування, що перешкоджає утворенню відповідних водневих зв'язків в а-спіралі. З тієї ж причини спирализация ланцюга утруднена в результаті відштовхування близько розташованих позитивно заряджених хімічних угруповань лізину або аргініну. Великі розміри радикалів амінокислот також є причиною, по якій спирализация поліпептидного ланцюга утруднена (серин, треонін, лейцин). Найбільш часто інтерферують фактором при утворенні а-спіралі є амінокислота пролін. Як відомо, в проліном атом азоту входить до складу жорсткого кільця, що перешкоджає обертанню навколо зв'язку N-Са. Крім того, пролін не утворює внутріцепочечную водневу зв'язок через відсутність при атомі азоту водневого атома. Таким чином, у всіх випадках, коли в поліпептидного ланцюга зустрічається пролин, а-спіральна структура порушується і утворюється клубок або р-вигин.
Р-Структура. На відміну від а-спіралі p-структура утворена за рахунок межцепочечних водневих зв'язків між сусідніми ділянками поліпептидного ланцюга, так як внугріцепочечние контакти відсутні. Якщо ці ділянки спрямовані в одну сторону, то така структура називається паралельної (ср = -119 °, ц / = + 113 °) (рис. 3.2), якщо ж в протилежну (р = -139е, у = +135 °), то анти паралельної (рис. 3.3).
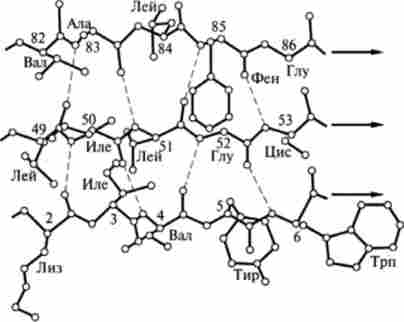
Мал. 3.2. Паралельна p-структура флаволокеіна (по В. М. Степанову): пунктиром показані водневі зв'язку
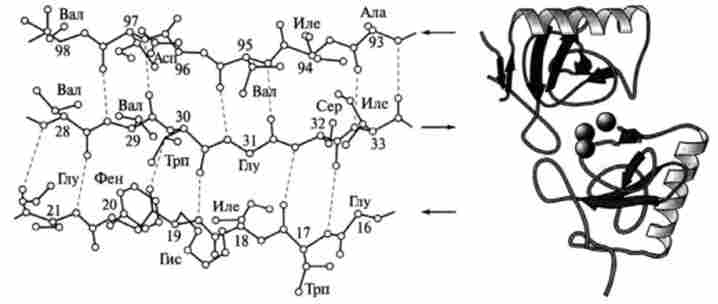
Мал. 3.3. Анти паралельна і кристалічна структури супероксиддисмутази
Поліпептидний ланцюг в p-структурі сильно витягнута і має не спіральну, а скоріше зигзагоподібну форму. Відстань між сусідніми амінокислотними залишками по осі становить 0,35 нм, т. Е. В три рази більше, ніж в а-спіралі, число залишків на виток дорівнює 2.
У разі паралельного розташування p-структури водневі зв'язку менш міцні в порівнянні з такими при антипаралельними розташуванні амінокислотних залишків. На відміну від а-спіралі, насиченою водневими зв'язками, кожна ділянка поліпептидного ланцюга в p-структурі відкритий для утворення додаткових водневих зв'язків. Сказане стосується як до паралельної, так і до антипараллельной p-структурі, проте в антипараллельной структурі зв'язку більш стабільні. У відрізку поліпептидного ланцюга, що утворює p-структуру, знаходиться від трьох до семи амінокислотних залишків, а сама p-структура складається з 2-6 ланцюгів, хоча їх число може бути і більшим. p-Структура має складчасту форму, залежну від відповідних а-вугле- рідних атомів. Поверхня її може бути плоскою і левозакрученной таким чином, щоб кут між окремими відрізками ланцюга становив 20-25 ° (рис. 3.4).
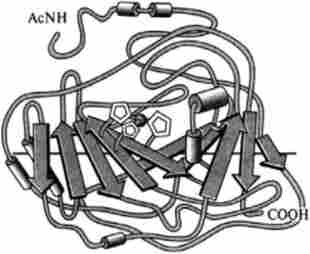
Мал. 3.4. Протяжний р-складчастий шар (в карбангідразс людини)
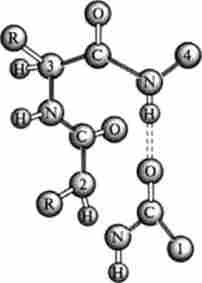
Мал. 3.5. р-Вигин поліпептидного ланцюга (по В. М. Степанову)
р-Вигин. Глобулярні білки мають кулясту форму багато в чому завдяки тому, що для поліпептидного ланцюга характерна наявність петель, зигзагів, шпильок, причому напрямок ланцюга може змінюватися навіть на 180 °. В останньому випадку має місце p-вигин (рис. 3.5).
Цей вигин за формою нагадує шпильку для волосся і стабілізується однієї водневої зв'язком. Фактором, що перешкоджає його утворенню, можуть бути великі бічні радикали, і тому досить часто спостерігається включення в нього найменшого амінокислотного залишку - гліцину. Ця конфігурація виявляється завжди на поверхні білкової глобули, в зв'язку з чим р-вигин бере участь у взаємодії з іншими поліпептидними ланцюгами.
Супервторічние структури. Вперше супервторічние структури білків були постульовано і потім виявлені Л. Полингом і Р. Корі. Як приклад можна привести суперспіралізованную а-спіраль, в якій дві а- спіралі скручені в ліву суперспіраль (рис. 3.6). Однак чаші суперспіральну структури включають в себе як а-спіралі, так і р-складчатис листи. Їх склад може бути представлений таким чином: (cm), (ар), (ра) і (РХР). Останній варіант є два паралельних складчастих листа, між якими знаходиться статистичний клубок (РСР), а-спіраль (РАР) або p-структура (РРР).
Співвідношення між вторинної і супервторічной структурами має високу ступінь варіабільності і залежить від індивідуальних особливостей тієї чи іншої білкової макромолекули.
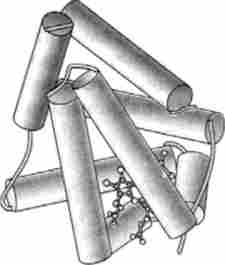
Домени - більш складні рівні організації вторинної структури. Вони являють собою відокремлені глобулярні ділянки, з'єднані один з одним короткими так званими шарнірними ділянками поліпептидного ланцюга. Д. Бірктофт одним з перших описав доменну організацію химотрипсина, зазначивши наявність двох доменів у цього білка. Кожен з них має циліндричну форму, утворену p-структурою, і складається з 6 антипаралельних ланцюгів. В один з цих доменів входять 139 амінокислот з УУ-кінця, інший - С-кінцевий включає в себе 115 амінокислотних залишків.
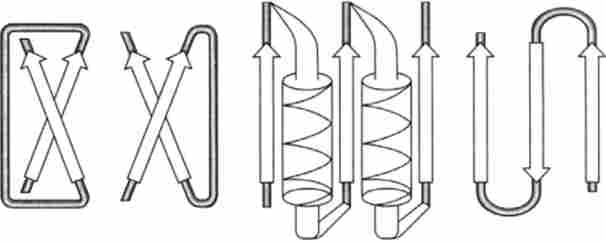
Мал. 3.6. Супервторічние p-структури:
циліндрами позначені а-спіралі; затемнені області - нсспірялізованние ділянки; стрілки - р-складчасті шари
Доменна організація характерна для багатьох білків. У цих білках, як правило, знаходиться кілька структурних доменів, кожен з яких містить до 200 амінокислотних залишків. Прикладом тому може бути білок гліцеральдегідфосфатдегідрогеназа (ГАФД) (рис. 3.7).
У деяких білках, наприклад в імуноглобулінах або серінових про- тсіназах, структурні домени подібні за своєю первинну структуру, що вказує на можливий механізм дублікації відповідних генів, в інших білках, наприклад в гемоглобіні, є певні відмінності
Мал. 3.8. Домени гемоглобіну людини: циліндри - u-спіралі; зв'язують їх нитки - аморфні ділянки (по PDB-2001) (Yang, J., Kloek, А. Р., Goldberg, D. Е., Mathews, FS: Proc. Natl. Acad. Sci. USA, 92. p. 4224, 1995)
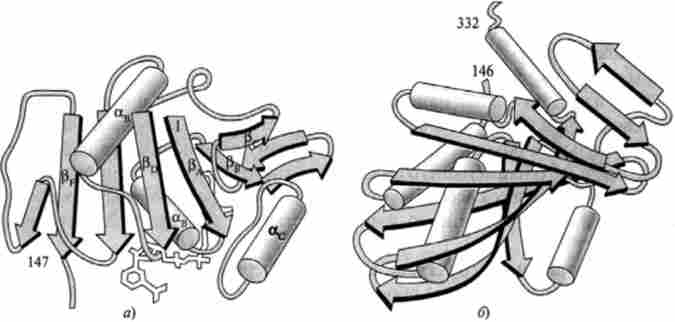
Мал. 3.7. Домени ГАФД з м'язів омара (по А. А. Анісімову): а - НАД "-зв'язуючим домен; 6 - каталітичний домен
(Рис. 3.8). За будовою домени в білках поділяють на кілька груп залежно від змісту в них а-спіралей і ^ -складчатих листів.
Таким чином, можна відзначити наступне.