| Головна |
| «« | ЗМІСТ | »» |
|---|
Специфічність дії. Ще в кінці XIX і на початку XX століття було встановлено, що здатність того чи іншого ферменту каталізувати перетворення певного речовини (субстрату) залежить від природи як ферменту, так і субстрату. Висока виборча здатність взаємодії ферменту з компонентами біологічної реакції особливо наочно проявляється при оцінці стсрсохімічсскіх перетворень. Е. Фішер одним з перших показав високу стереоспеціфічность ряду ферментів і постулював, що це обумовлено комплементарним приєднанням субстрату до ферменту в процесі каталітичної реакції. Це особливо яскраво проявляється в процесі реакцій, характерних для L- або D-форм субстрату. Наприклад, фермент лак- татдегідрогеназа каталізує перетворення тільки L-форми молочної кислоти і повністю інертний щодо її D-форми. L-Аспарагиназа, що каталізує реакцію перетворення аспарагина, діє тільки на його L-форму:

Ферменти характеризуються високою специфічністю як щодо субстратів, так і каталізують ними реакцій. Крім стереохимичної, виділяють абсолютну і відносну специфічність дії ферментів.
абсолютна специфічність передбачає, що фермент каталізує тільки одну реакцію. Наприклад, аргіназа розщеплює аргінін на орнітин і сечовину:
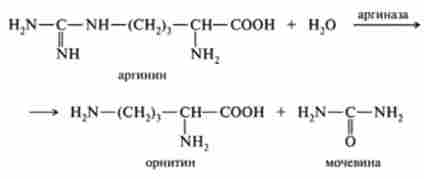
Слід зазначити, однак, що загальноприйняте поняття «абсолютна специфічність» певною мірою умовно. Так, глюкозооксидаза, специфічно окислююча D-глюкозу з утворенням глюконової кислоти, діє ще принаймні на 8-10 субстратів, таких, як манноза, мальтоза, лактоза і ін. З огляду на той факт, що швидкість окислення цих субстратів нижче в порівнянні з глюкозою приблизно на два порядки, цими даними часто нехтують і глюкозооксидазу вважають ферментом, котрі виявляють абсолютну специфічність. Разом з тим дослідження впливу ферменту на близькі за будовою субстрати виявилися надзвичайно плідними в іншому відношенні. З'ясувалося, що на швидкість ферментативної реакції впливає не тільки природа атакується зв'язку, але і її оточення, а також довжина вуглецевого ланцюга субстрату. Це особливо характерно для ферментів, які проявляють відносну, або групову, специфічність. Дані ферменти діють на групу близьких за будовою субстратів з порівнянної швидкістю, проте кожен індивідуальний фермент проявляє характерні особливості впливу на той чи інший субстрат. Найбільш детально вивчена групова специфічність дії протеїназ, які каталізують гідроліз білків і поліпептидів. Виявилося, що пепсин (фермент шлункового соку) гідролізує пептидні зв'язки, утворені тирозином або фенилаланином. Наявність вільної аминной групи поблизу від гідролізованого зв'язку на кілька порядків зменшує швидкість ферментативної реакції. Навпаки, вільна карбоксильна група стимулює ферментативний гідроліз, причому це характерно тільки для пепсину. Хімотрипсин також гідролізує пептидні зв'язки, утворені ароматичними амінокислотами, проте на відміну від пепсину впливає на зв'язки, утворені карбоксильними групами ароматичних амінокислот.
(Т) Таким чином, можна сказати, що ферменти мають специфічністю по відношенню до будь-якого субстрату або до певної хімічної зв'язку в різних субстратах.
Слід зазначити, що один і той же фермент може бути поліфункці- онального, т. З. каталізувати різні біохімічні реакції. Як приклад можна привести трипсин - фермент, який синтезується підшлунковою залозою і секретується в кишечник. Будучи протеолітичних ферментів, він гідролізує пептидні зв'язки, утворені карбоксильною групою аргініну або лізину. Крім того, трипсин каталізує гідроліз амідних зв'язків (це було встановлено при роботі з синтетичним субстратом бензоил - L-аргінінамідом), а також гідролізують складноефірний зв'язку між амінокислотою і спиртом.
Для деяких протеолітичних ферментів характерні реакції транс- пептідаціі - перенесення амінокислотних залишків від одного субстрату до іншого.
Інтенсивне вивчення біологічних каталізаторів дало можливість скласти цілісне уявлення про ці, по суті, найбільш важливих структурах живої матерій. Зокрема, було встановлено, що всі ферменти є макромолекулами білкової природи. (Каталітична активність специфічних полинуклеотидов, які беруть участь в сплайсинге РНК, є винятком, що підтверджує загальне правило.) Першорядне значення для функцій ферментів має первинна структура, що визначає тип каталізуються реакцій. Гідроліз пептидних зв'язків трипсином або пепсином необоротно інактивує ферменти. Для прояву каталітичної дії велике значення має також нативні вищих білкових структур (гл. 3). Оборотна денатурація є фактором придушення або відновлення ферментативної активності. Фізико-хімічні властивості ферментів відповідають таким для білків, причому заряд грає істотне значення для каталітичного акта. Молекулярні маси ферментів лежать в межах від 10 до 1000 kDa і більш, т. Е. В більшості випадків фермент за розмірами набагато більше, ніж субстрат.
Як і білки, ферменти бувають простими і складними, причому каталітична дія пов'язане з невеликою ділянкою білкової макроструктури, цілісність якої проте вельми істотна для ферментативного каталізу. Будучи щирими каталізаторами, ферменти не ініціюють хімічні реакції, вони лише змінюють швидкість їх протікання. Важливо відзначити, що ферменти не тільки збільшують швидкості реакцій в клітинах або тканинах, вони з декількох рівно можливих спонтанних реакцій «вибирають» ту, яка найбільш доцільна для процесу життєдіяльності.
Ферменти, так само як і хімічні каталізатори неорганічної природи, каталізують тільки енергетично вигідні реакції, не змінюють напрямки реакції і не витрачаються в процесі реакції. Разом з тим ферменти мають ряд властивостей, що відрізняють їх від хімічних каталізаторів: