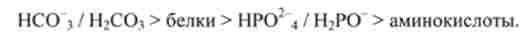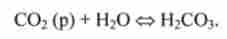
| Головна |
| «« | ЗМІСТ | »» |
|---|
Кров людини являє собою суспензію клітин в рідкому середовищі. Кислотно-основну рівновагу в крові забезпечується спільною участю буферних систем плазми і клітин: водородкарбонатной, фосфатної і білкової буферними системами.
Нормальне значення pH плазми крові становить 7,40 ± 0,05. Цьому відповідає інтервал значень активної кислотності а (Н *) від 3,7 до 4,0-10 х моль / л. Так як в крові присутні різні електроліти - НСО'з, Н2СО3, Н2РО 4< НРО '4. білки, амінокислоти, це означає, що вони дисоціюють в такій мірі, щоб концентрація з * (Н+) Перебувала в зазначеному інтервалі. На цьому заснований кислотно-основний гомеостаз - постійність кислій реакції крові.
У зв'язку з тим що вміст неорганічних і органічних речовин в плазмі і клітинах крові неоднаково, доцільно розглянути ці складові крові окремо.
У плазмі крові функціонує кілька буферних систем.
Водородкарбонатная буферна система НСО ~ з / Н2СО3 складається з вугільної кислоти Н2СО3 і сполученого підстави НСО "*. Це найбільш важлива буферна система крові. Її особливість в тому, що один з компонентів - вугільна кислота Н2СО3 - утворюється при взаємодії розчиненого в плазмі ССЬ з водою:
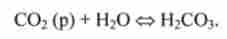
Константа рівноваги цієї реакції дорівнює
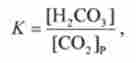
де [С02]р - концентрація розчиненого СО2.
Між СО2 в альвеолах і водородкарбонатним буфером в плазмі крові, що протікає через капіляри легень, встановлюється ланцюжок рівноваг:
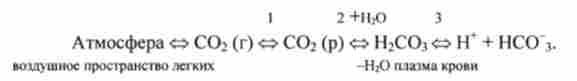
Відповідно до рівнянням Гендерсона-Гассельбаха типу (8.11) pH водень карбонатного буферного розчину визначається відношенням концентрації кислоти Н2СОз і солі NaHCCb:
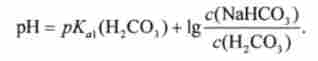
Згідно ланцюжку рівноваг зміст Н2СО3 визначається концентрацією розчиненого СОГ, яка, згідно із законом Генрі, пропорційна парціальному тиску СО2 в газовій фазі:
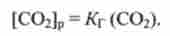
В кінцевому рахунку виявляється, що з (Н2СОз) пропорційна р (С02), І вираз Гендерсона-Гассельбаха набирає вигляду
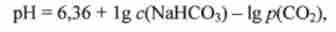
де 6,36 - негативний десятковий логарифм константи дисоціації вугільної кислоти рКа (Н2СО3) з поправкою на константу Генрі; р (СО2) - парціальний тиск СО2 в альвеолах легенів.
Водородкарбонатная буферна система діє як ефективний фізіологічний буферний розчин поблизу pH 7,4.
При надходженні в кров кислот - донорів Ьг - рівновага 3 в ланцюжку, за принципом Ле Шательє, зміщується вліво в результаті того, що іони НСО 3 пов'язують іони Н 'в молекули Н2СО3. При цьому концентрація Н2С03 підвищується, а концентрація іонів НСО 3 відповідно знижується. Підвищення концентрації Н2СО3. в свою чергу, призводить до зміщення рівноваги 2 вліво (принцип Ле Шательє). Це викликає розпад Н2С03 і збільшення концентрації СО2, розчиненого в плазмі. В результаті змішається рівновагу 1 вліво і підвищується тиск СО2 в легенях. Надлишок СО2 виводиться з організму.
При надходженні в кров підстав - акцепторів Н+ - зрушення рівноваг в ланцюжку відбувається в зворотній послідовності.
В результаті описаних процесів водородкарбонатная система крові швидко приходить в рівновагу з СО2 в альвеолах і ефективно забезпечує підтримання сталості pH плазми крові.
Внаслідок того що концентрація NaHC03 в крові значно перевищує концентрацію Н2СО3, буферна ємність цієї системи буде значно вище за кислоті. Інакше кажучи, водородкарбонатная буферна система особливо ефективно компенсує дію речовин, що збільшують кислотність крові. До числа таких речовин перш за все відносять молочну кислоту HLac, надлишок якої утворюється в результаті інтенсивного фізичного навантаження. Цей надлишок нейтралізується в наступному ланцюжку реакцій:
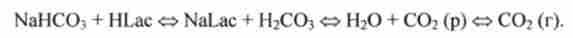
Таким чином, ефективно підтримується нормальне значення pH крові при слабо вираженому зсуві pH, обумовленому ацидозом. У замкнутих приміщеннях часто відчувають ядуху - брак кисню, почастішання дихання. Однак задуха пов'язано не стільки з нестачею кисню, скільки з надлишком СО2. Надлишок СО2 в атмосфері відповідно до закону Генрі призводить до додаткового розчинення СО2 в крові. А це відповідно до рівнянням Гендерсона- Гассельбаха призводить до зниження pH крові (т. Е. До ацидозу):
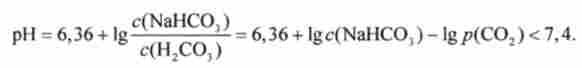
Водородкарбонатная буферна система найбільш швидко відгукується на зміну pH крові. Її буферна ємність по кислоті складає Вдо = 40 ммоль / л плазми крові, а буферна ємність лугу значно менше і дорівнює приблизно Вш= 1-2 ммоль / л плазми крові.
Фосфатна буферна система НРО 4 / Н2Р0 4 складається з слабкої кислоти Н2РО 4 і сполученого підстави НРО2 4- В основі її дії лежить кислотноосновного рівновагу:
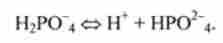
Фосфатна буферна система здатна чинити опір зміні pH в інтервалі величин 6,2-8,2, т. Е. Забезпечує значну частку буферної ємності крові.
З рівняння Гендерсона-Гассельбаха для цієї буферної системи випливає, що в нормі при pH 7,4 ставлення концентрацій солі (НР04") І кислоти (Н2Р04) Становить приблизно 1,6. Це випливає з рівності
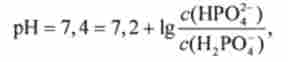
де
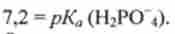
Звідси
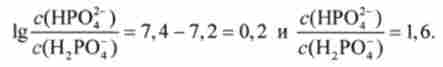
Фосфатна буферна система має більш високу ємність по кислоті, ніж по лугу. Тому вона ефективно нейтралізує кислі метаболіти, що надходять в кров, наприклад молочну кислоту HLac:
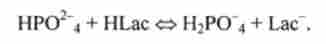
Роль цієї системи особливо важлива при інтенсивних м'язових навантаженнях, що супроводжуються виділенням лактату.
Однак відмінності буферної ємкості даної системи по кислоті і луги не настільки великі, як у водородкарбонатной: Вдо = 1-2 ммоль / л; Вш = 0,5 ммоль / л. Тому фосфатна система бере участь в нейтралізації як кислих, так і основних продуктів метаболізму. У зв'язку з малим вмістом фосфатів в плазмі крові вона менш потужна, ніж водородкарбонатная буферна система.
Білкова буферна система складається з «білка-підстави» і «білка-солі». Відповідне кислотно-основну рівновагу
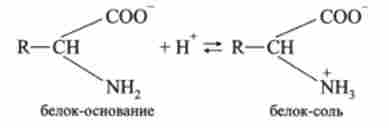
в середовищах, близьких до нейтральних, зміщене вліво і «білок-підставу» переважає.
Основну частину білків плазми крові (-90%) складають альбуміни і глобуліни. Ізоелектричної точки цих білків (число катіонних і аніонних груп однаково, заряд молекули білка дорівнює нулю) знаходяться в області значень pH 4,9-6,3 (слабокисла середу), тому в фізіологічних умовах при pH 7,4 білки знаходяться переважно в формах « білок-підставу »і« білок-сіль ».
Буферна ємність, яка визначається білками плазми, залежить від концентрації білків, їх вторинної та третинної структури і числа вільних протон- акцепторних груп. Ця система може нейтралізувати як кислі, так і основні продукти. Однак внаслідок переважання форми «білок-підставу» її буферна ємність значно вище за кислоті і становить для альбумінів Вдо = 10 ммоль / л, а для глобулінів Вдо = 3 ммоль / л.
Буферна ємність вільних амінокислот плазми крові незначна як по кислоті, так і по лугу. Це пов'язано з тим, що майже всі амінокислоти мають значення рКа дуже далекі від рКа - 7. Тому при фізіологічному значенні pH їх потужність мала. Практично тільки одна амінокислота - гістидин (рКа = 6.0) - володіє значним буферним дією при pH, близьких до pH плазми крові.
Таким чином, потужність буферних систем плазми крові зменшується в напрямку