
| Головна |
| «« | ЗМІСТ | »» |
|---|
Відщеплення карбоксильної групи амінокислот у вигляді СО, каталізується декарбоксилаз амінокислот, які дуже широко поширені в природі. Приклади ферментативного декарбоксилювання амінокислот і їх похідних у різних видів живих організмів представлені в табл. 24.3.
У тварин тканинах виявлено декарбоксилирование тирозину, триптофану, 5-оксітріптофана, валіну, серину, гістидину, глутамінової та у-оксіглут- ам і нової кислот, 3,4-диоксифенилаланина, цистеїну і цістеінсульфі нової кислоти, аргініну, орнітину, S-адснозіл метіоніну , а-аміномалоновой кислоти.
Серед різних типів декарбоксилирования амінокислот для організму людини і тварин найбільше значення має а-декарбоксілірованіс, т. Е. Відщеплення карбоксильної групи при а-вуглецевому атомі і утворення продуктів реакції амінів, що володіють, як правило, сильним фармакологічною дією і тому названих біогенними амінами.

Таблиця 24.3. Ферментативне дскарбоксілірованіе амінокислот
і їх похідних (по Т. Т. Березову і Б. Ф. Коровкін, 1983)
|
субстрат |
продукт реакції |
поширення |
||
|
тварини |
рослини |
мікроорганізми |
||
|
5-Аденоз метіонін |
S- аденозил гомоцістсамін |
+ |
+ |
|
|
«-Амінобензойная кислота |
анілін |
+ |
||
|
а-Аміномалоновая кислота |
гліцин |
+ |
||
|
а-аміномасляної кислоти |
пропіламін |
+ |
||
|
антранілова кислота |
анілін |
+ |
||
|
L-аргініл |
агматину |
+ |
||
|
L-Аспарагінова кислота |
р-Аланін |
+(?) |
+ |
|
|
L-Аспарагінова кислота |
а-Аланін |
+ |
||
|
L-Валін |
2-Метил пропіламін |
+ |
+ |
+ |
|
L-Гистидин |
гістамін |
+ |
+ |
|
|
Дві молекули гліцину |
2С02 + 2NH3 + СН, СООН |
+ |
||
|
L-Глутамінова кислота |
у-аміномасляної кислоти |
+ |
+ |
+ |
|
Мезо-а; е-діамінопімеліновая |
L-Лізин |
+ |
||
|
кислота |
||||
|
3,4-діоксіфенілаланін |
3.4-Діоксіфенілетіламін |
+ |
+ |
+ |
|
L-Ізолейцин |
2 - М стіл Буг мул а м і н |
+ |
+ |
|
|
L-Лейцин |
3 - Мстілбутіл ами н |
+ |
+ |
|
|
L-Лізин |
кадаверин |
+ |
||
|
у-Метілен- L-глутамінова |
у-Аміно-а-метілеімасляная |
+ |
||
|
кислота |
кислота |
|||
|
Норвалін |
«-Бутил амін |
+ |
||
|
Алло-р-оксіглутаміновая кислота |
у-Аміно-і-оксимасляная кислота |
+ |
||
|
у-Оксіглутаміновая кислота |
а-Оксі-у-аміномасляна кислота |
+ |
+ |
|
|
5-оксилізину |
2-Оксікадавсрін |
+ |
||
|
5-оксітріптофан |
серотонін |
+ |
||
|
«-Оксіфенілсерін |
«-Оксіфеніламіноетанол |
+ |
||
|
L-Орнитин |
путресцин |
+ |
+ |
|
|
L-Ссрін |
етаноламін |
+ |
||
|
L-Тирозин |
тирамін |
+ |
+ |
+ |
|
L-Трігттофан |
Трітамін |
+ |
||
|
L-Феніл аланин |
феніл етиламін |
+ |
+ |
|
|
L-цистеїнових кислота |
таурин |
+ |
||
|
L-Цістсінсульфіновая кислота |
Гіпотаурін |
+ |
||
Реакції дскарбоксілірованія, на відміну від інших процесів проміжного обміну амінокислот, є незворотними. Декарбоксилази амінокислот є складними ферментами, коферментами яких, як і у трансаміназ, є піридоксальфосфат (ПФ), специфічність їх дії визначається апобелковим компонентом ферменту. Механізм реакції дскарбоксілірованія амінокислот у відповідності з теорією пірідоксалевого каталізу пов'язаний з утворенням шіффово підстави між пиридоксальфосфатом і амінокислотою, лабілізацісй всіх зв'язків в субстраті (А, Ь, с), що обумовлює здатність амінокислоти вступати в реакції трансамініро- вання (а), Декарбоксилювання (b), Альдольної розщеплення (с).
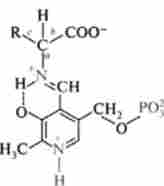
шіффово підставу між амінокислотою і пірілоксальфосфатом
Неспецифічна декарбоксилаза ароматичних амінокислот каталізує декарбоксилювання триптофану, 5-гідроксітріптофана і 3,4-діоксі- фенілаланіну (ДОФА). Продуктами реакцій, крім С02, є відповідно триптаміну, серотонін і діоксіфенілетіламін (дофамін):
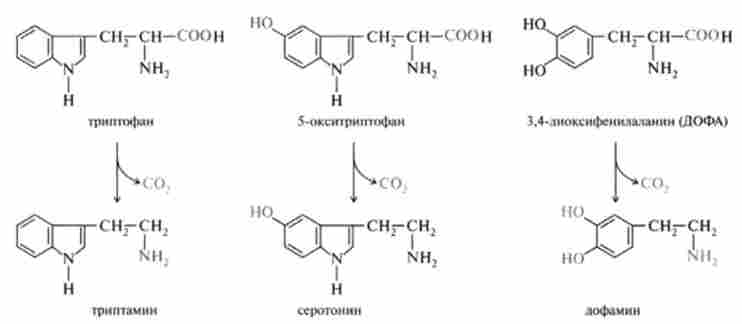
Утворені біогенні аміни - триптаміну, серотонін, дофамін володіють сильним фармакологічною дією на безліч фізіологічних функцій людини і тварин. Так, триптаміну і серотонін надають судинозвужувальну дію. Крім цього, серотонін бере участь в регуляції артеріального тиску, температури тіла, дихання і ниркової фільтрації, є нейромедіатором, який викликає зміну поведінки, наприклад при шизофренії. Дофамін, можливо, сам є нейромедіатором, а також попередником широко відомого медіатора норадреналіну та гормону адреналіну. Джерелом ДОФА в організмі є тирозин, який під дією специфічної гідроксилази перетворюється в 3,4-діок- сіфенілаланін. Тирозингідроксилази відкрита в надниркових залозах, в тканинах мозку і периферичної нервової системи.
Іншим прикладом освіти біологічно активних амінів в процесі декарбоксилювання амінокислот є утворення гістаміну (з гістидину), великі кількості якого виділяються із стовбурових клітин сполучної тканини, викликаючи алергічну реакцію у відповідь на дію алергену:

Кількість гістаміну збільшується при різних патологічних станах організму: травмах, стресі, а також при введенні в організм різних отрут і деяких лікарських речовин (антибіотиків, лікувальних сироваток та ін.).
Гістамін має широкий спектр біологічної дії. Багато гістаміну утворюється у вогнищі запалення, володіючи судинорозширювальну дію, він прискорює приплив лейкоцитів і тим самим активує захисні сили в боротьбі з інфекцією. Велика кількість гістаміну утворюється в слизовій шлунка, де він активує секрецію пепсину і соляної кислоти.
Важливу біологічну функцію виконує у-аміномасляна кислота (ГАМК) - продукт а-декарбоксилирования глутамінової кислоти. Фермент, що каталізує цю реакцію (глутаматдекарбоксилази), є високоспецифічний:

Обидва ці сполуки - глутамат і ГАМК - відносяться до нейромедіатора: ГАМК пригнічує, а глутамат активує передачу нервових імпульсів. Введення у-аміномасляної кислоти викликає гальмівний процес в корі головного мозку (центральне гальмування), а у тварин призводить до втрати умовних рефлексів. у-аміномасляної кислоти використовується в клініці при лікуванні деяких захворювань ЦНС, пов'язаних з різким порушенням кори головного мозку.
До біогенних амінів відноситься також таурин, який утворюється з цистеїну і використовується в печінці при утворенні парних жовчних кислот:
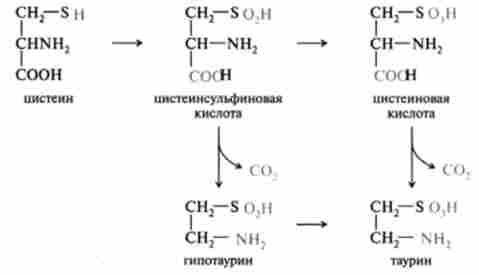
Таким чином, біогенні аміни є сильними, фармакологічно активними речовинами, що виявляють різнобічну дію на фізіологічні функції організму. Деякі біогенні аміни (гістамін.
серотонін, їх похідні) знайшли широке застосування в якості лікарських засобів.