| Головна |
| «« | ЗМІСТ | »» |
|---|
У 1970 р в США в лабораторії Х. Г. Корани вперше був здійснений синтез гена. Це був цистрон, що кодує дріжджову тРНК/, Й, що складається з 77 пар нуклеотидів. Синтез здійснювали поступово, приєднуючи нуклеотиди один за іншим. Отримані хімічним синтезом фрагменти з'єднували між собою за допомогою ДНК-лігази фага Т4. Пізніше Х. Г. Корана синтезував ген тирозинового супрессорной РНК, що складається з 207 нуклеотидів.
Хімічний синтез гена став найбільшим досягненням біооргані- чеський хімії і молекулярної біології. Він відкрив шлях прямого отримання необхідних генів для технології рекомбінантних ДНК і став важливою умовою прогресу генетичної інженерії.
Метод, розроблений Х. Г. Кораною, був потім застосовано для синтезу генів гормонів інсуліну і соматостатину.
Інсулін - гормон підшлункової залози, який регулює вуглеводний обмін і підтримує нормальний рівень цукру в крові. Інсулін - невеликий глобулярний білок, що містить 51 амінокислотний залишок і складається з двох поліпептидних ланцюгів, пов'язаних між собою двома дисульфідними містками. Синтезується він у вигляді одноланцюжкові попередника - препроінсуліну, що містить кінцевий сигнальний пептид (23 амінокислотних залишку) і 35-Ланки сполучні пептид (С-пептид). При видаленні сигнального пептиду в клегке утворюється проінсулін з 86 амінокислотних залишків, в якому А- і ss-ланцюга інсуліну з'єднані С-пептид, що забезпечує їм необхідну орієнтацію при замиканні дисульфідних зв'язків. Після протеолітичного відщеплення С-пептиду утворюється інсулін.
Генно-інженерне отримання інсуліну почалося в кінці 70-х рр. XX ст. У 1978 р з'явилося повідомлення про отримання штаму кишкової палички, яка продукує щурячий проінсулін (США). У цьому ж році були синтезовані окремі ланцюга людського інсуліну за допомогою експресії їх синтетичних генів в клітинах Е. coli (Рис. 15.10). Кожен з отриманих синтетичних генів підлаштовувався до -кінцю гена ферменту ss-галактозидази і вводився в векторну плазміду (pBR322). клітини Е. coli,
трансформовані такими рекомбінантними плазмідами, виробляли гібридні (химерні) білки, що складаються з фрагмента ss-галактозидази і А- або ss-пептиду інсуліну, приєднаного до плазмиде Е. coli через залишок метіоніну. При обробці химерного білка бромцианом пептид звільняється. Однак замикання дисульфідних містків між освіченими ланцюгами інсуліну відбувалося з працею.
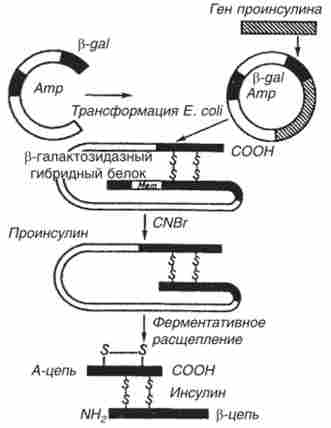
Мал. 15.10. Схема синтезу інсуліну
У 1981 р синтезований ген-аналог проінсуліну - міні-С-проінсулін, в якому 35-ланки С-пептид був замінений на сегмент з шести амінокислот: А-А-Г-С-А-А-; показана його експресія в Е. coli.
Співробітниками інституту біоорганічної хімії під керівництвом академіка Ю. А. Овчинникова був здійснений синтез двох структурних генів, що кодують синтез нейропептидів: лейцин-енкефаліну і брадікі- нина. Синтезований ген лейцин-енкефаліну мав два «липких кінця» (рис. 15.11).
Отриманий синтетичний ген був вбудований разом з фрагментом природного ДНК, що містить промотор і проксимальну частина гена білка ss-галактозидази кишкової палички, в плазміду-вектор pBR322 і оброблений сумішшю рестриктаз - ЕсоШ і BamHl. Отримана рекомбінантна плазміда річок була трансформована в клітини кишкової палички. В результаті експресії вбудованого гена (рис. 15.11) бактерія початку продукувати гібридний (химерний) білок, який містить на одному кінці ділянку р-галактозидази, а на іншому - С-кінці - послідовність нейропептіда. За допомогою бромціан химерний білок розщеплює in vitro і отримували активний лейцин-енкефалінів.
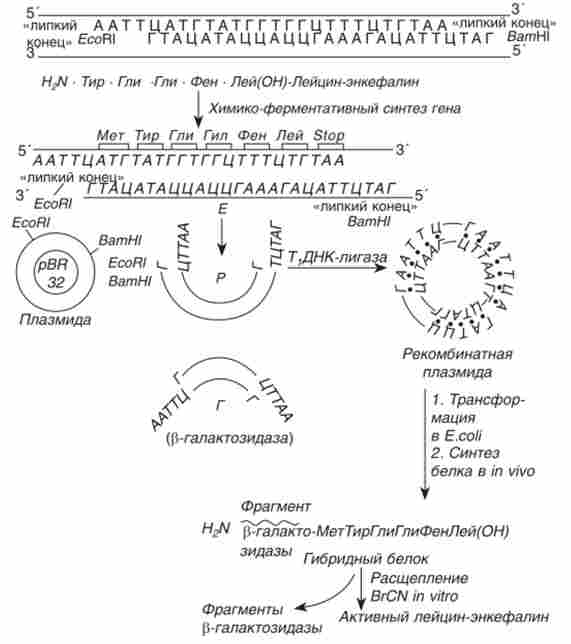
Мал. 15.11. Схема синтезу гібридного і активного лейцин-енкефаліну
Хімічний синтез полідезоксірібонуклеотідов в даний час практично повністю автоматизований. Його проводять на установках, які називаються синтезаторами ДНК.