| Головна |
| «« | ЗМІСТ | »» |
|---|
Під терміном «ліпіди» об'єднують жири і жироподібні речовини різної структури, що мають загальні властивості. Головне властивість ліпідів - гидрофобность: вони не розчиняються у воді, але розчиняються в органічних розчинниках (бензині, ефірі, ацетоні та ін.). У деяких клітинах ліпідів мало (5-15% від сухої маси), а в клітинах підшкірної жирової клітковини ссавців їх зміст досягає 90%.
Ліпіди поділяють:
Жири - найбільш прості і широко поширені ліпіди. Це з'єднання трехатомного спирту гліцерину ( «головка») і трьох залишків високомолекулярних жирних кислот ( «хвости»). Серед них розрізняють жири, що залишаються твердими при температурі 20 ° С, і масла, які в цих умовах стають рідкими. Масла більш характерні для рослин, але зустрічаються і у тварин. Воску покривають шкіру, шерсть, пір'я тварин, що оберігає їх від дії води. Стебла, листя і плоди багатьох рослин також можуть бути покриті восковим захисним шаром.
Фосфоліпіди за своєю структурою схожі з жирами, але в їх молекулі один або два залишку жирних кислот заміщені залишком фосфорної кислоти. Фосфоліпіди є основним складовим компонентом клітинних мембран. Гліколіпіди - з'єднання ліпідів з вуглеводами, які також зазвичай входять до складу клітинних мембран, коли вони присутні переважно на зовнішній поверхні. Ліпопротеїди - сполуки різних білків з ліпідами.
Опціїліпідів:
захисна. Підшкірна жирова клітковина, а також жир, який відкладається навколо внутрішніх органів, добре захищає організм від механічних впливів. Восковий наліт на листках рослин оберігає їх від зайвого випаровування води;
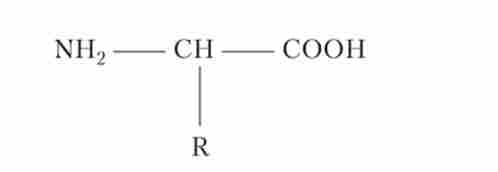
Мал. 1.1. Структурна формула амінокислоти
З органічних речовин в організмі найбільше білків - 10-20% маси клітини. Білки є гетерополімера, мономерами яких є амінокислоти. Всі амінокислоти схожі за будовою. Кожна з них містить аміногрупу (-NH2) і карбоксильну групу (-СООН). Відрізняються амінокислоти частиною, яку називають радикал (R) (рис. 1.1).
У клітинах і тканинах виявлено понад 170 різних амінокислот, але до складу білкової молекули входить тільки 20 з них. Залежно від того, чи можуть амінокислоти синтезуватися в організмі, розрізняють: замінні амінокислоти - десять амінокислот, синтезованих в організмі, і незамінні амінокислоти, які в організмі не синтезуються. Білки повинні надходити в організм разом з їжею.
Залежно від амінокислотного складу білки бувають повноцінними, якщо містять весь набір незамінних амінокислот, і неповноцінними, якщо хоча б одна незамінна амінокислота в їх складі відсутній.
Коли дві амінокислоти з'єднуються один з одним, від аміногрупи однієї кислоти і карбоксильної групи іншої відщеплюєтьсямолекула Н20, і за рахунок валентностей залишки амінокислот з'єднуються. Утворене при цьому з'єднання називають дипептидом, а зв'язок між амінокислотами - пептидним зв'язком (рис. 1.2).
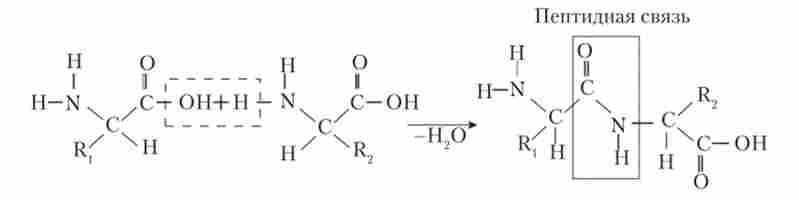
Мал. 1.2. Освіта пептидного зв'язку між двома амінокислотами:
Ri, R2 - радикали двох різних амінокислот
У разі з'єднання трьох амінокислот утворюється трипептид, кількох - поліпептид. Таким чином, білки являють собою поліпептиди, т. Е. Ланцюжка з амінокислотних залишків. Послідовність цих залишків в білкової молекулі визначає його первинну структуру. Вона визначає властивості молекул білка і її просторову конфігурацію. Заміна всього лише однієї амінокислоти на іншу в поліпеп- тідной ланцюжку може привести до зміни властивостей і функцій білка. У міру утворення білкової ланцюжка вона закручується в спіраль - вторинну структуру білка. Поліпептидна спіраль певним чином укладається в просторі, формуючи третинну структуру. У кожного виду білків третинна структура має свою конфігурацію. Деякі білки мають і четвертинних структуру, в цьому випадку кілька молекул з третинної структурою об'єднуються, утворюючи одну молекулу (рис. 1.3).
Залежно від конфігурації молекули білки діляться на три групи.
мембранні, які кілька разів проходять через клітинну мембрану; при цьому їх частини виходять з мембрани в цитоплазму клітини і в міжклітинну середу.
Крім того, білки ділять на прості (протеїни), які утворені тільки амінокислотами, і складні (протеїди), що містять крім амінокислот небілкову частина (наприклад, ліпопротеїди - сполуки білків з ліпідами, нуклсопротеіди - білків і нуклеїнових кислот, глікопротеїди - білків і вуглеводів) .
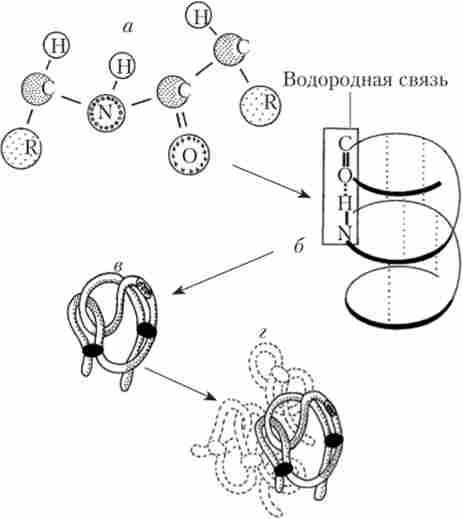
Мал. 1.3. Структура білкової молекули:
а - первинна; 6 - вторинна; в - третинна; г - четвертичная
Білкові молекули дуже різноманітні. Вони відрізняються один від одного кількістю вхідних в їх склад амінокислот (від ~ 50 до -5000) і послідовністю амінокислот у поліпептидному ланцюжку. Ця послідовність закодована в генах ДНК. Кожен організм містить величезну кількість білків. При цьому частина з них видоспецифічність, т. Е. Однакова для всіх представників конкретного виду. Наприклад, молекула інсуліну в нормі у всіх людей однакова, але у представників інших видів вона відрізняється але будовою (найближча до людського інсулін належить свиням). Але багато білків індивідуальні навіть в межах одного виду, т. Е. Багато білків одну людину відрізняються за будовою від білків іншого.
Білки відіграють надзвичайно важливу роль в роботі організму, причому через складність будови, а також різноманітності форм і складу функції білків дуже численні. виділяють наступні функції білків.
- будівельна (структурна). Білки входять до складу багатьох структур організму, як клітинних, так і позаклітинних - цитоплазматичних мембран, кісток, волосся, нігтів, сухожиль і ін .;
ферментативна (каталітична), одна з найважливіших функцій білків. Ферменти - це біокаталізатори, т. Е. Речовини, в десятки тисяч разів прискорюють перебіг біохімічних реакцій. Молекула ферменту зазвичай набагато більший, ніж молекула речовини, на яке він діє (субстрату). На молекулі ферменту є ділянка, яка називається «активний центр». У цій ділянці субстрат зв'язується з ферментом за принципом «ключ до замка», субстрат повинен відповідати за формою і заряду активного центру. Ферменти мають високу специфічність - кожен з них взаємодіє з одним субстратом і виконує одну дію, наприклад, розриває молекулу субстрату на дві частини або, навпаки, об'єднує дві молекули різних або однакових субстратів в одну, відновлює або окисляє молекулу субстрату і т. Д. Деякі ферменти крім білкової мають небілкову частина - кофермент, або кофактор. Білкову частина ферменту в цьому випадку називають апо- фермент. Коферментами можуть бути похідні вітамінів, іони деяких металів і ін .;