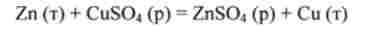 електрони від атомів цинку переходять до іонів міді:
електрони від атомів цинку переходять до іонів міді:| Головна |
| «« | ЗМІСТ | »» |
|---|
Окислювально-відновні реакціями називають хімічні процеси, що супроводжуються переносом електронів від одних молекул або іонів до інших.
Наприклад, при витісненні міді з розчину C11SO4 цинком Zn
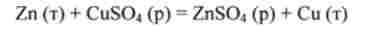 електрони від атомів цинку переходять до іонів міді:
електрони від атомів цинку переходять до іонів міді:
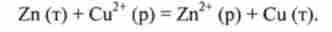
При окисно-відновних реакціях протікають два взаємопов'язані процеси: окислення і відновлення.
-^ -Окислення називається процес втрати електронів, відновленням називається процес приєднання електронів.
Речовини, атоми або іони яких віддають електрони, називають відновниками (Red) (від лат. «Reductio» - повернення). Речовини, атоми або іони яких приєднують електрони (або відтягують до себе загальну пару електронів), називають окислювачами (Ох) (від грец. «Oxys» - кислий).
В реакції цинку з CuS04 іони Сі2+ приєднують електрони:
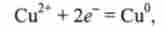
атоми цинку віддають електрони:
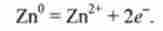
відповідно CuS04 - окислювач, Zn - відновник.
Важливими процесами в життєдіяльності організму є ферментативні окислювально-відновні реакції розщеплення харчових речовин - субстратів: вуглеводів, жирів, амінокислот. В результаті цих реакцій організм отримує велику кількість енергії. Приблизно 90% всієї потреби дорослого чоловіка в енергії покривається за рахунок енергії, що виробляється в тканинах при окисленні вуглеводів і жирів. Іншу частину енергії (~ 10%) дає окислительное розщеплення амінокислот.
Біологічне окислення протікає по складних механізмів за участю великої кількості ферментів (див. Біоокислення глюкози, розд. 9.4). В мітохондріях окислення відбувається в результаті переносу 2 електронів е від органічних субстратів - інтермедіатів - на елементний кисень 62, який при цьому відновлюється до води:
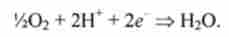
Як переносників електронів у дихальний ланцюг мітохондрій входять різні білки, що містять різноманітні функціональні групи, які призначені для перенесення електронів. У міру просування по ланцюга від одного интермедиата до іншого електрони втрачають вільну енергію. На кожну пару електронів, переданих по дихальної ланцюга кисню, синтезуються три молекули АТФ. Вільна енергія, що виділяється при перенесенні двох електронів на кисень, становить 220 кДж / моль.
На синтез однієї молекули АТФ в стандартних умовах витрачається 30,5 кДж. Звідси ясно, що досить значна частина вільної енергії, що виділяється при перенесенні однієї пари електронів, запасається в молекулах АТФ. З цих даних стає зрозумілою і роль многостадийной передачі електронів від вихідного відновника до кисню. Велика енергія (220 кДж), що виділяється при перенесенні однієї пари електронів до кисню, розбивається на ряд порцій, відповідних окремих стадіях окислення. На трьох таких стадіях кількість енергії, що виділяється приблизно відповідає енергії, необхідної для синтезу однієї молекули АТФ.
Окислювально-відновні реакції лежать в основі методів оксіді- метрії, які застосовують в клінічних, а також в санітарно-гігієнічних аналізах. Ці методи використовують для визначення в крові іонів кальцію, сечової кислоти, ферментів - каталази і пероксидази, глюкози. У санітарно-гігієнічних цілях визначають окислюваність води, зміст «активного» хлору в хлорного вапна, залишковий хлор в господарсько-питній воді.