| Головна |
| «« | ЗМІСТ | »» |
|---|
Відтворення і дію генів пов'язані з матричними процесами - синтезом макромолекул: ДНК, РНК, білків. Вище вже розглядалася реплікація як процес, що забезпечує відтворення генетичної інформації. Сучасна теорія гена - досягнення молекулярної генетики - цілком спирається на успіхи біохімії у вивченні матричних процесів. І навпаки, метод генетичного аналізу вносить істотний внесок у вивчення матричних процесів, які самі знаходяться під генетичним контролем. Дія гена забезпечує транскрипцію, або синтез РНК, і трансляцію, або синтез білка (рис. 5.23).
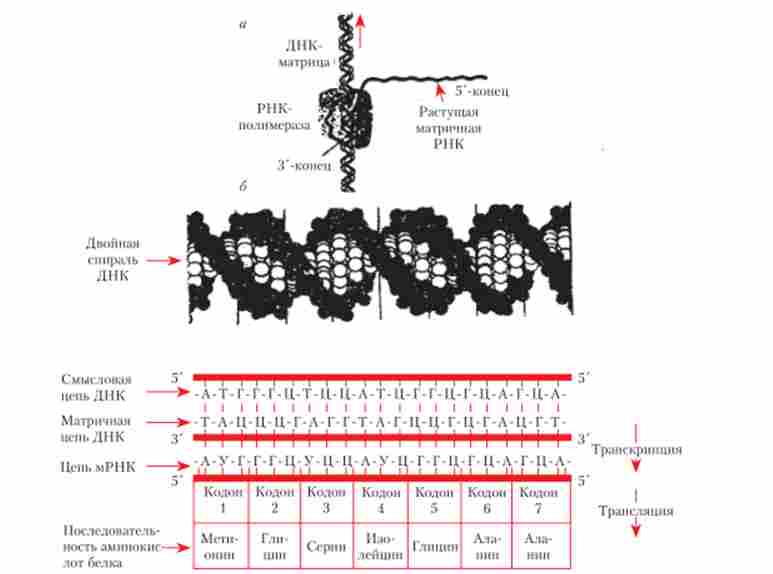
Мал. 5.23. Схема процесу транскрипції ДНК РНК-полімерази і трансляції: а - загальна схема транскрипції. Стрілка показує напрямок, в якому ДНК-матриця рухається через молекулу РНК-полімерази; б - два етапи: транскрипція і трансляція
Процес синтезу білка починається з транскрипції ДНК (як розглядалося вище). Наступний процес - трансляція мРНК.
трансляція мРНК - це синтез білка на рибосомах, що направляється матрицею мРНК. При цьому інформація перекладається з чотирибуквене алфавіту нуклеїнових кислот на двадцатібуквенний алфавіт амінокислотних послідовностей поліпептидних ланцюгів.
У цьому процесі розрізняють три стадії:
Таким чином, при трансляції послідовність розташування нуклеотидів в мРНК переводиться в відповідну, строго впорядковану послідовність розташування амінокислот в молекулі синтезованого білка.
сигналом ініціації трансляції у про- і еукаріот служить кодон АУГ, якщо він розташований на початку мРНК. В цьому випадку його «дізнається» спеціалізована ініціює формілметіоніновая (у бактерій) або метіонінових (в еукаріот) тРНК. В інших випадках кодон АУГ «читається» як метіонінових (див. Табл. 5.4.). Сигналом ініціації може також служити кодон ГУГ. Ця взаємодія відбувається на рибосомі в її аміноацільном центрі (^-центрі), розташованому переважно на малій субодиниці рибосоми.
Взаємодія кодону АУГ інформаційної РНК, малої субодиниці рибосоми і формілметіоніл-тРНК утворює комплекс ініціації. Суть цієї взаємодії полягає в тому, що до кодону АУГ на мРНК приєднується своїм антикодоном УАЦ тРНК, яка захопила і несуча молекулу амінокислоти метіоніну (у бактерій инициаторной є тРНК, яка переносить формілметіонін). Потім до цього комплексу, що складається з малої субодиниці рибосоми (305), мРНК і тРНК, приєднується велика субодиниця рибосоми (505). В результаті утворюється повністю зібрана рибосома, що включає одну молекулу мРНК і инициаторного тРНК з амінокислотою. У рибосомі є аміноацільний і пептіділь- ний центри.
Перша амінокислота (метіонін) спочатку потрапляє в аміноацільний центр. В процесі приєднання більшої субодиниці рибосоми мРНК просувається на один кодон, тРНК з аміноацільного центру переміщається в пептідільний центр. У аміноацільний центр надходить наступний кодон мРНК, який може з'єднатися з антикодоном наступної амі- ноаціл-тРНК. З цього моменту починається друга стадія трансляції - елонгація, в ході якої багаторазово повторюється цикл приєднання молекул амінокислот до зростаючої поліпептидного ланцюга. Так, в аміноаціль- ний центр рибосоми надходить відповідно до кодоном інформаційної РНК друга молекула тРНК, що несе чергову амінокислоту. Ця тРНК своїм антикодоном з'єднується з комплементарним кодоном мРНК. Відразу ж за допомогою пептіділтрансферази попередня амінокислота (метіонін) з'єднується своєї карбоксильною групою (-СООН) з аминогруппой (NH2) знову доставленої амінокислоти. Між ними утворюється пептидний зв'язок (-CO-NH-). При цьому виділяється молекула води:
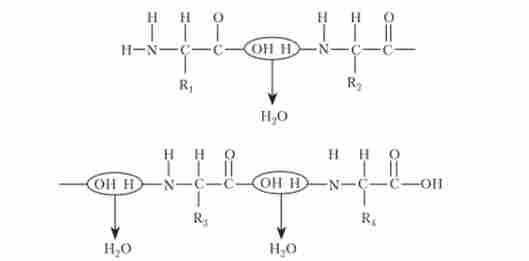
В результаті тРНК, що доставила метіонін, звільняється, а в аміноацільном центрі до тРНК виявляється приєднаним вже дипептид. Для подальшого здійснення процесу елонгації повинен бути звільнений аміноацільний центр, що і відбувається.
В результаті процесу трансляції комплекс діпсптнділ-тРНК просувається з аміноацільного центру в пептідільний. Це відбувається завдяки переміщенню рибосоми на один кодон за участю ферменту транслокази і білкового фактора елонгації. Звільнена тРНК і кодон мРНК, який був пов'язаний з нею, виходять з рибосоми. Наступна тРНК доставляє в звільнився аміноацільний центр амінокислоту відповідно до котрі вступили туди кодоном. Ця амінокислота за допомогою пептидного зв'язку з'єднується з попередньої. При цьому рибосома просувається ще на один кодон, і процес повторюється до тих пір, поки в аміноацільний центр нс надійде один з трьох терминирующего кодонів (нонсенс-кодонів), т. Е. УАА, УАГ або УГА.
Після надходження в аміноацільний центр рибосоми терминирующего кодону настає третій етап синтезу поліпептиду - термінація. Вона починається з приєднання до терминирующего кодону мРНК одного з білкових факторів термінації, що призводить до блокування подальшої елонгації ланцюга. Терминация синтезу призводить до звільнення синтезованої поліпептидного ланцюга і субодиниць рибосоми, які потім диссоциируют і можуть взяти участь в синтезі наступної поліпептидного ланцюга.
Весь процес трансляції супроводжується розщепленням молекул ГТФ (гуанозінтріфосфата), причому необхідна участь додаткових білкових факторів, специфічних для процесів ініціації (факторів ініціації), елонгації (факторів елонгації) і термінації (факторів термінації). Ці білки не є інтегральною частиною рибосоми, а приєднуються до неї на певних етапах трансляції. У загальних рисах процес трансляції однаковий у всіх організмів.
Утворені при синтезі білка поліпептидні ланцюга зазнають постгрансляціонние перетворення і в подальшому виконують свої специфічні функції. первинна структура полипептида визначається послідовністю розташування в ньому амінокислот. Поліпептидні ланцюги мимовільно формують певну вторинну структуру, яка визначається природою бічних груп амінокислотних залишків (а-спіраль, складчастий P-шар, випадковий клубок). Всі ці та інші структурні особливості визначають деяку фіксовану тривимірну конфігурацію, яку називають третинної (або просторової) структурою поліпептиду, відбиває спосіб укладання даної поліпептидного ланцюга в тривимірному просторі.
Білки можуть складатися з однієї або декількох поліпептидних ланцюгів. У другому випадку їх називають олігомерними білками. Для них характерна певна четвертичная структура. Під цим терміном мають на увазі загальну конфігурацію білка, що виникла при асоціації всіх вхідних в її склад поліпептидних ланцюгів. Зокрема, структурна модель людського гемоглобіну включає в себе дві a-ланцюги і дві P-ланцюга, які пов'язані між собою і утворюють четвертичную білкову структуру.
Точність поліпептидного синтезу залежить від правильності освіти системи водневих зв'язків між кодонами і антикодон. До замикання черговий пептидного зв'язку за допомогою рибосом здійснюється перевірка правильності освіти пари кодон-антикодон. Пряме свідчення на користь активної ролі рибосом в контролі комплементар- ності кодон-антикодоновой зв'язку - виявлення мутацій, що змінюють рибосомні білки і таким чином впливають на точність трансляції.