| Головна |
| «« | ЗМІСТ | »» |
|---|
Подібно амінокислотам, білки поєднують в собі як кислотні, так і основні властивості. Будучи амфотерними поліелектролітами, білки проте істотно відрізняються від вільних амінокислот, кислотно-основні властивості яких обумовлені а-аміно- і а-карбоксильними групами. У білках основний внесок у формування кислотно-основних властивостей вносять заряджені радикали амінокислотних залишків, розташовані на поверхні білкової глобули. Основні властивості білків пов'язані з такими амінокислотами, як аргінін, лізин або гістидин, а кислі - з аспарагінової і глутамінової амінокислотами. Що стосується а-амінних і а-кар боксільних груп амінокислот, то їх іонізація нс має істотного значення, так як переважна їх кількість бере участь в утворенні пептидних зв'язків. Криві титрування білків досить складні для інтерпретації. Це пов'язано, по-перше, з наявністю великої кількості тітруемих груп, а також з тим, що рДо для кожної титруемой групи в білку може істотно відрізнятися від такої в амінокислоті. Це пов'язано з електростатичними взаємодіями між іонізованими групами білка, наявністю близько розташованих гідрофобних залишків, а також впливом водневих зв'язків.
У процесі титрування білка від гранично кислої до гранично основної форми повинно існувати таке значення pH, при якому сумарний заряд білка дорівнює нулю. Це значення pH носить назву ізоелектричної точка (Р /). При значенні pH, рівному ізоелектричної точці, білок максимально інертний, не рухається в електричному полі і має найбільш тонку гідрадну оболонку. Більшість білків мають ізоелектричної точки при нейтральних або близьких до них значеннях pH, однак є ряд винятків, наприклад, для ферменту шлункового соку пепсину р / = 1,4, а для ферменту рибонуклеази - 10,5. Якщо в білковому розчині немає ніяких іонів, крім іонізованих амінокислотних залишків, то такі розчини називаються ізоіоннимі.
Білки, будучи амфотерними електролітами, проявляють буферні властивості, хоча їх буферна ємність в більшості випадків незначна. Виняток становлять білки, що містять велику кількість залишків гістидину, наприклад гемоглобін, що забезпечує стабільні значення pH всередині еритроцитів.
розчинність білків залежить від pH, а також від іонної сили розчину, яка визначається за рівнянням
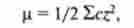
де р - іонна сила; з - молярна концентрація; z - заряд іона.
При високій іонній силі білкового розчину спостерігається конкуренція між білковими молекулами і іонами солі за молекули води. Ступінь гідратації білка знижується, взаємодія білок-білок при цьому стає ефективніше, ніж білок-вода, і білок осідає. Розчинність багатьох білків при цьому пов'язана з іонною силою розчину наступним рівнянням:
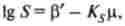
де 5 "- розчинність, г / л; Р '- розчинність білка в гіпотетичному розчиннику при іонної силі, рівній нулю; Ks- константа висолювання.
У розчинах білки проявляють колоїдні властивості, такі, як явище світлорозсіювання (ефект Тиндаля), нездатність проходити через напівпроникні мембрани, висока в'язкість, освіта гелів і ін. Разом з тим білки не є істинними колоїдами, так як вони здатні утворювати молекулярні розчини. Основна схожість між колоїдними частинками і білками полягає в тому, що вони мають більш-менш близькі розміри. Білки так само, як і справжні колоїди, можуть утворювати гелі, що представляють собою сітчасті структури, заповнені водою.