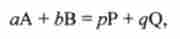
| Головна |
| «« | ЗМІСТ | »» |
|---|
В ході хімічної реакції кількість реагентів зменшується, а кількість продуктів зростає. Відповідно змінюються концентрації реагентів і продуктів. При досягненні хімічного рівноваги концентрації речовин в системі перестають змінюватися і залишаються постійними як завгодно довго при незмінних зовнішніх умовах. Ці концентрації називають рівноважними.
Норвезькі физикохимик К. Гульдберг і П. Вааге встановили (1864) на основі аналізу експериментальних даних закон діючих мас для хімічної рівноваги. Цей закон визначає співвідношення між рівноважними концентраціями реагентів і продуктів реакції.
Закон діючих мас є наслідком 2-го закону термодинаміки, так як виводиться з відповідного термодинамічної умови рівноваги. Щоб вивести закон діючих мас, розглядають оборотну у напрямку реакцію загального вигляду
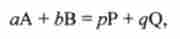
де А, В - реагенти; Р, Q - продукти; а, b4p, q- відповідні стехіометричні коефіцієнти.
На основі виразу хімічних потенціалів (5.13) для реагентів і продуктів реакції через концентрації після алгебраїчних перетворень приходять до наступного виразу для енергії Гіббса даної реакції:

тут
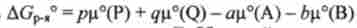 - постійна для даної реакції
- постійна для даної реакції
величина, що дорівнює енергії Гіббса цієї реакції при стандартних умовах.
величина

називається стехиометричним співвідношенням початкових концентрацій речовин А, В, Р, Q, що беруть участь в реакції при заданих умовах.
Як випливає з 2-го закону термодинаміки, при рівновазі AG = 0 з рівності (5.14) отримують

де Кс - значення Пз при хімічному рівновазі.
Очевидно, що Доз виражається через концентрації аналогічно Пз. Але замість довільних початкових концентрацій з (А), з (В), с (Р), c (Q) треба брати рівноважні концентрації, які позначають за допомогою квадратних дужок відповідно [А], [В], [Р], [Q ]. тоді Доз для реакції аА + ЬВ = р? + qQ записується у вигляді
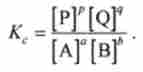
Енергія Гіббса реакції AG ° p. * При стандартних умовах - величина постійна. Тому з рівняння (5.14) випливає, що Доз для даної реакції при даних температурі і тиску - величина постійна при будь-яких початкових концентраціях речовин А, В, Р, Q, що беруть участь в реакції:

величину Доз називають константою рівноваги реакції аА + ? В = Р? + qQ. Співвідношення (5.17) є математичною записом закону діючих мас, який формулюється таким чином.
-? Для оборотної хімічної реакції загального вигляду АА + ЬВ = РР + qQ при постійних зовнішніх умовах в рівновазі відношення творів концентрацій продуктів до добутку концентрацій реагентів з урахуванням стехиометрии є величина постійна, яка не залежить від хімічного складу системи:
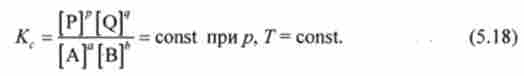
Як випливає з виразу (5.18), одиниці виміру константи рівноваги визначаються стехіометрією реакції. Наприклад, для розглянутої вище реакції водню Нг (г) з йодом Ь (т) константа рівноваги записується у вигляді
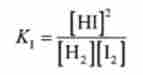
і є величиною безрозмірною.
Для реакції II кисню ОГС гемоглобіном нь константа рівноваги дорівнює
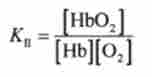 і її одиниця виміру - л / моль.
і її одиниця виміру - л / моль.
Енергія Гіббса реакції AGp. "І константа рівноваги Доз за даних умов пов'язані між собою. Якщо підставити вирази AG ° p + і Пз з рівності (5.16) і (5.15) в рівняння (5.14), вийде просте співвідношення

де
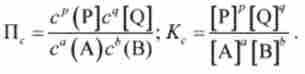
Співвідношення (5.19) називають рівнянням ізотерми хімічної реакції АА + ЬВ = pP + qQ. За допомогою рівняння ізотерми можна розрахувати енергію Гіббса хімічної реакції ДПР.я при заданому значенні AG ,,. *, якщо відома константа рівноваги реакції Доз. І навпаки, якщо відома енергія Гіббса реакції AGp. "При заданому Пз, т. е. заданих концентраціях реагентів і продуктів, можна розрахувати константу рівноваги Доз.
При стандартних умовах концентрації реагентів і продуктів приймають рівними 1 моль / л. Отже, відповідно до вираження (5.18) отримують, що nt = 1 і рівняння ізотерми реакції (5.19) для стандартних умов переходить в рівняння (5.16). З рівняння (5.16) випливає, що константа рівноваги Доз пов'язана зі стандартною енергією Гіббса реакції AG ° p. «співвідношенням

Підстановка в рівняння (5.20) значень АСР.я для розглянутих реакцій I- III дає наступні константи рівноваги: для реакції I водню з йодом Доз = 0,52, для реакції II гемоглобіну з киснем Доз = 86 л / моль, для реакції III окислення глюкози Доз= 10 500 моль5* Л ~5.
Невеликі значення констант рівноваги для реакцій I і II дозволяють зробити висновок, що при 298 К помітно йдуть як пряма, так і зворотна реакція. Дуже велике значення Доз для реакції III окислення глюкози вказує на практично необоротне її протікання в стандартних умовах. Ці висновки узгоджуються зі зробленими раніше за значеннями стандартних енергій Г Іббсе реакцій.
Якісну оцінку напрямки досліджуваної реакції при заданих концентраціях легко зробити, якщо відома константа рівноваги. Для цього по заданих концентрацій розраховують значення Пз і визначають ставлення UJKC. якщо njKc « 1, реакція йде в прямому напрямку, так як відповідно до рівняння (5.19) енергія Г Іббсе реакції негативна.
За допомогою рівняння ізотерми (5.19) можна визначити напрям реакції загального вигляду а а + 6В = РР + qQ для заданих вихідних концентрацій з (А), з (В), с (Р), c (Q) речовин А, В. Р і Q при постійній температурі Г.
Якщо задані концентрації реагентів з (А), з (В) і продуктів з (Р), c (Q) є такими, що Пз < Доз (Рівновагу зрушено вліво), то ставлення П^ Доз < 1, In TJKC 0 і AGp. " < 0. Відповідно до 2-м початком термодинаміки це означає, що реакція повинна йти мимовільно в прямому напрямку, т. Е. Вправо.
Якщо задані концентрації реагентів і продуктів такі, що Пз > Доз (Рівновагу зрушено вправо), відношення ПCJKC > 1, In Пс / Кз > 0 і AGp_ " > 0. Відповідно до 2-м початком термодинаміки реакція повинна йти мимовільно в зворотному напрямку, т. Е. Вліво.
Якщо при заданих концентраціях реагентів і продуктів Пз = Доз відношення Пt/ Kc = 1, AGp. * = 0, то по 2-му закону термодинаміки має місце рівновага.