
| Головна |
| «« | ЗМІСТ | »» |
|---|
Оборотні у напрямку фізичні процеси (фазові переходи) застосовні не тільки до хімічних, а й до фізичних процесів.
До оборотним у напрямку фізичним процесам ставляться розчинення, випаровування і плавлення речовин, а також осадження, конденсація і кристалізація речовин - процеси, їм зворотні. Такі процеси називають фазовими переходами. При цьому речовина з одного агрегатного стану (г, ж, т) переходить в інше (г, ж, т), не змінюючи свого хімічного складу.
Фазові переходи зручно зображувати у вигляді схем (квазіхімічних рівнянь) переходу речовини X з однієї фази в іншу:

У міру наближення до рівноваги енергія Гіббса системи зменшується, а при досягненні рівноваги стає мінімальною і перестає змінюватися. Склад фаз також перестає змінюватися, і зміна енергії Гіббса в процесі AG = 0, отже, в розглянутих вище процесах при рівновазі AGpacr »= 0, AGIW = 0, AGHCI1 = 0.
Енергія Гіббса системи в цілому може бути розрахована як сума енергій Г Іббсе складових систему речовин - компонентів системи. Для таких розрахунків використовується хімічний потенціал речовини.
Хімічним потенціалом речовини X в даній системі називається величина, яка визначається енергією Гіббса системи, що припадає на 1 моль цієї речовини при заданих умовах:

де ц (Х) - хімічний потенціал речовини X, Дж / моль; G (X) - енергія Гіббса речовини X у системі, Дж; «(X) - кількість речовини X у системі, моль.
Таким чином, якщо речовина X міститься в системі в кількості л, то енергія Гіббса цієї речовини дорівнює

Якщо система складається з декількох речовин Х |, Х2, Хз в кількостях Л |, л2, «З» то енергія Г Іббсе системи визначається сумою
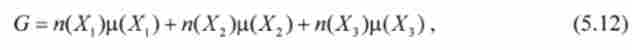
де р (Х |), р (Х2), Р (Хз) - хімічні потенціали речовин Х |, Х2, Х3.
Якщо речовина X знаходиться в розчині, хімічний потенціал цієї речовини залежить від концентрації і природи розчинника. Аналіз експериментальних даних показує, що така залежність носить логарифмічний характер і має такий вигляд:
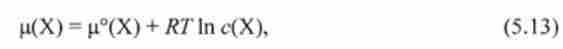
де р (Х) - хімічний потенціал речовини X, Дж / моль; р ° (Х) - стандартний хімічний потенціал, постійна для даної речовини X величина, яка не залежить від концентрації; In - логарифм натуральний (при заснуванні
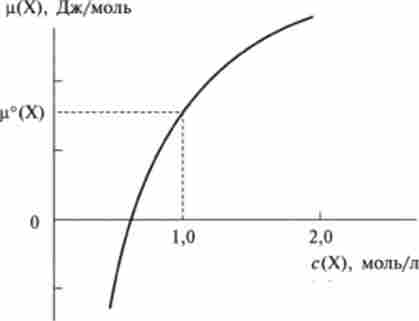
Мал. 5.6. Залежність хімічного потенціалу ц (Х) речовини X від його концентрації с (Х) в розчині
На рис. 5.6 зображений графік залежності хімічного потенціалу ц (Х) речовини X від його концентрації в розчині з (Х). Графік наочно показує, що хімічний потенціал речовини монотонно зростає зі збільшенням концентрації цієї речовини в системі. При цьому по мерс збільшення концентрації швидкість зростання хімічного потенціалу зменшується. Стандартний хімічний потенціал ц ° (Х) дорівнює хімічному потенціалу речовини X при концентрації с (Х) = 1 моль / л, як це випливає з формули (5.13) і показано на рис. 5.6.
Властивості хімічного потенціалу в деякому відношенні подібні з властивостями електричного потенціалу. З фізики відомо, що при перенесенні позитивного електричного заряду q з точки з потенціалом ср | в точку з потенціалом ф2 система здійснює роботу -W = q (ср | - ср2), Якщо <р| > <р2 (Рис. 5.7, а). Аналогічно, відповідно до визначення енергії Гіббса, при перенесенні кількості л (Х) речовини X з розчину з хімічним потенціалом Ц | (Х) в розчин з хімічним потенціалом р2(Х) система здійснює роботу -W = л (Ц] - ЦГ) (рис. 5.7, б). Крім того, речовина мимовільно дифундує з області з великим хімічним потенціалом Ц | (Концентрація с (Х) більше) в область з меншим потенціалом ЦГ (концентрація с (Х) менше). Так само мимовільно рухається позитивний заряд в електричному полі від більшого потенціалу (pi до меншого СР2.
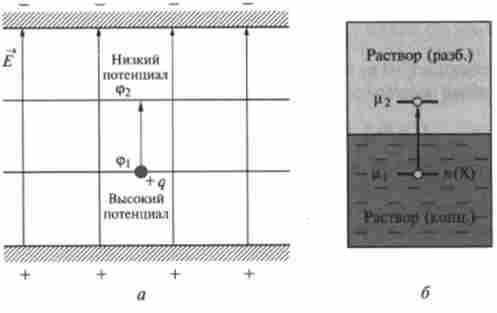
Мал. 5.7. Аналогія між потенціалом <р электричного поля ? (о) и химичним потенциалом ц концентрационного поля с (Х) (6)