| Головна |
| «« | ЗМІСТ | »» |
|---|
Як зазначалося раніше, незамінні амінокислоти не синтезуються в організмі людини і тварин, їх необхідно включати до складу їжі для забезпечення оптимального росту і для підтримки азотистого балансу. Для людини є незамінними наступні амінокислоти: лейцин, ізолейцин, валін, лізин, метіонін, фенілаланін, триптофан, треонін, гістидин і аргінін. Вісім з перерахованих амінокислот виявилися незамінними для багатьох вивчених видів вищих тварин. Що ж стосується гистидина і аргініну, то ці амінокислоти можуть синтезуватися в організмі, але в кількості, що не забезпечує оптимального росту і розвитку. Інша працювати з усіма іншими незамінними амінокислотами, так як організм зовсім втратив в ході еволюції здатність синтезувати їх вуглецеві ланцюги, т. Е. «Незамінним» у незамінних амінокислот є їх вуглецевий скелет. Вищі рослини і більшість мікроорганізмів здатні до активного синтезу цих амінокислот. Шляхи їх біосинтезу у різних видів організмів ідентичні або близькі і набагато складніше, ніж шляхи освіти замінних амінокислот. У багатьох з цих реакцій беруть участь такі посередники, як тетрагидрофолієвая кислота (ТГФ), переносник одноуглеродних фрагментів (СН3, - СН2, - СНТ, -CHNH, - СН =) і З'-адено- зілметіонін - головний донор метильних груп в реакціях трансметилирования.
S'-аденозил метіонін утворюється в процесі АТФ-залежної реакції з метіоніну:
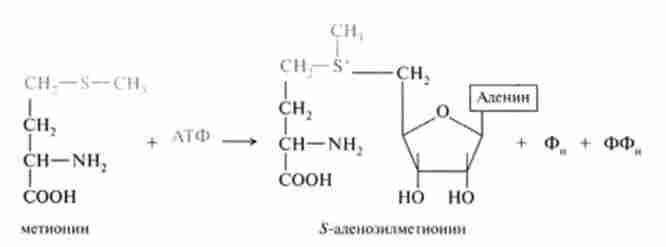
У ^ -аденозілметіоніне метильная група метіоніну активується під дією позитивно зарядженого сусіднього атома сірки, тому її реакційна здатність значно вище, ніж у УУ5-метілтетрагідрофолата (7У5-метил ТГФ).
Для прикладу розглянемо біосинтез метіоніну, треоніну і лізину, які відносяться до так званого биосинтетичної сімейства аспартату, т. е. в синтезі всіх трьох амінокислот в якості одного з попередників виступає аспартат.
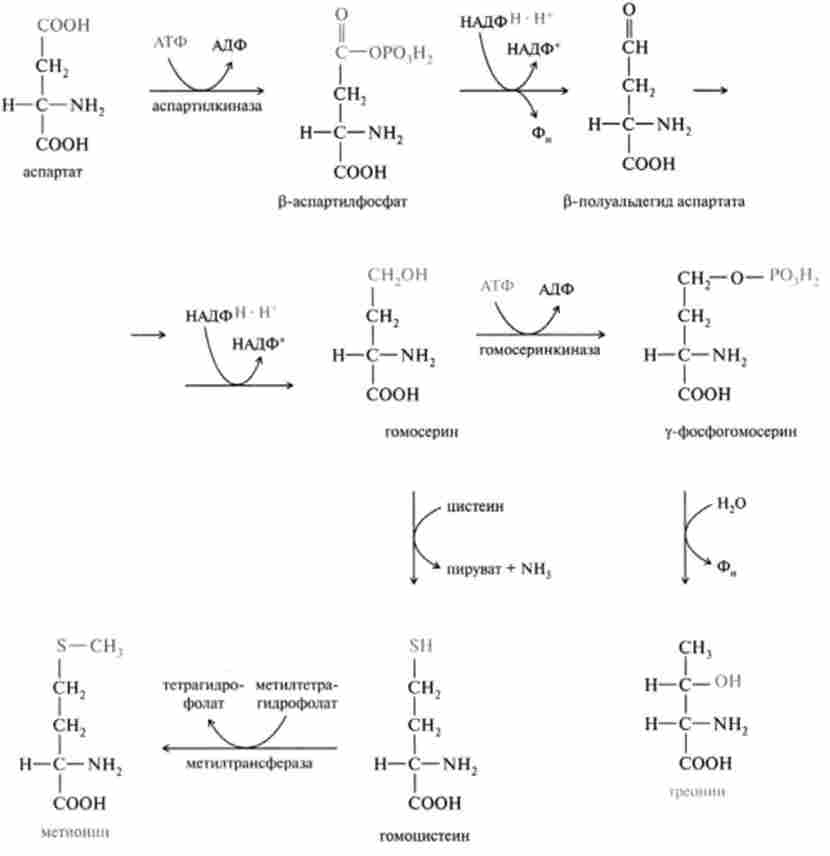
Метіонін і треонін синтезуються з аспартату за участю АТФ, НАДФН - Н+ і ряду ферментів, серед яких є пірідоксальфосфатзаві- сімие, а також ферменти, що містять в якості простетичної групи відновлене похідне кобаламина (вітамін В12). Мстільную групу при біосинтезі метіоніну поставляє М5-метілтетрагідрофолат. Перші етапи біосинтезу цих амінокислот до освіти гомосеріна протікають однаково, потім відбувається розгалуження шляхів:
Синтез изолейцина з треоніну на першому етапі каталізує фермент треоніндезаміназа, що перетворює треонин в а-кетобутірат:
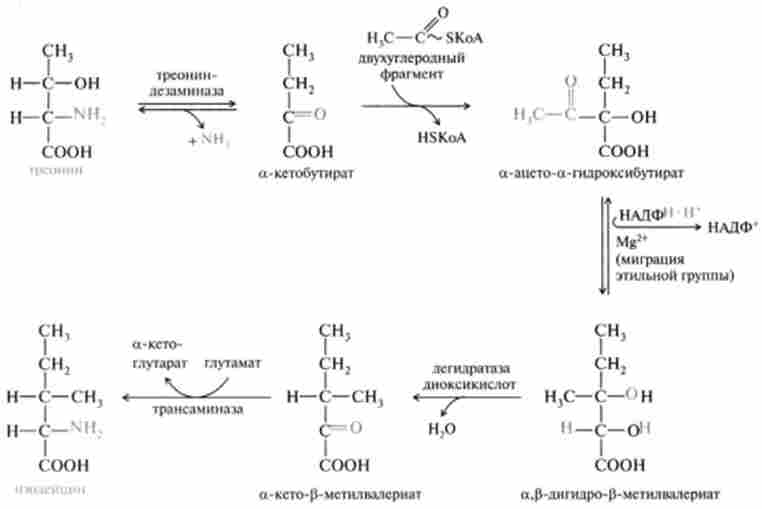
Останнє підключення конденсується з двухуглеродний фрагментом, в результаті чого утворюється а-ацето-а-гидроксибутират - ключовий проміжний продукт у синтезі изолейцина. Синтез изолейцина включає п'ять стадій, останнім заключним етапом є реакція трансамінірова- ня з глутамат.
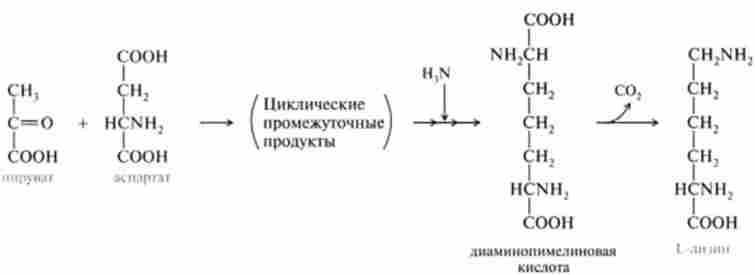
Лізин у бактерій і вищих рослин синтезується в результаті конденсації аспартату з пируватом через діамінопімсліновую кислоту:
У цвілевих грибів лізин утворюється з а-кстоглутарата і ацстіл-КоА через а-аміноадіпіновую кислоту.
Синтез ароматичних амінокислот фенілаланіну, тирозину і триптофану також йде по загальному шляху. Попередниками цих амінокислот є фосфосноілпіруват (проміжний метаболіт гліколізу) і еритро- зо-4-фосфат (проміжний метаболіт пснтозофосфатного шляху). Процес починається з їх конденсації і освіти семіуглеродного цукру, який потім ціклізуется з утворенням 5-дегідрохінной кислоти. Подальші перетворення останньої призводять до утворення шікімовой, а потім хо різмовой кислот, на стадії якої відбувається розгалуження шляхів синтезу природних амінокислот з триптофаном:
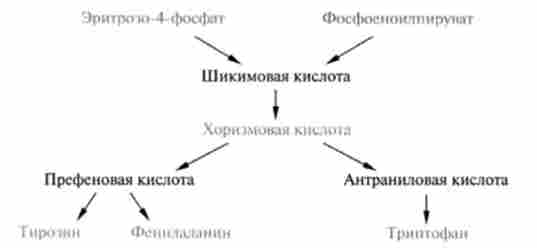
Слід зазначити, що назнавств на схемі шлях синтезу тирозину як незамінної амінокислоти виявлено у мікроорганізмів і рослин, в організмі людини і багатьох видів вищих тварин, як зазначалося вище, він синтезується шляхомгідроксилювання фенілаланіну.
Синтез амінокислот з розгалуженим ланцюгом (валін і лейцину), так само як і синтез гетероцикличної амінокислоти - гистидина, представляє складні багатоступінчасті процеси синтезу а-кетокислот, амінірованіе здійснюється, як правило, амідних азотом глутаміну або а-аміногруп- співай глутамінової кислоти.
Кілька спрощує ситуацію те, що всі 20 амінокислот, як замінні, так і незамінні, можуть бути поділені всього лише на шість биосинтетичних сімейств (рис. 24.15).
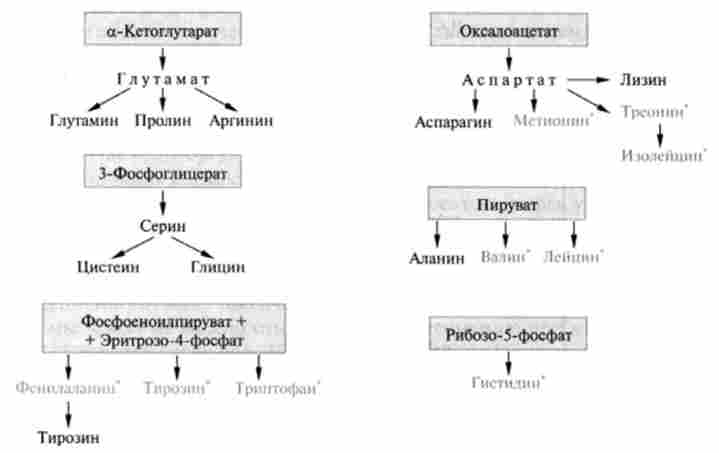
Мал. 24.15. Біосинтетичні сімейства амінокислот (по Л. Страйеру): виділені кольором метаболічні попередники; незамінні амінокислоти відзначені зірочками
Стає зрозумілим, чому харчова потреба в незамінних амінокислотах залежить від ряду умов, в тому числі від наявності або відсутності в їжі метаболічно близьких сполук. Так, наприклад, зниження потреби в тирозин зменшує кількість потрібного фенілаланіну, а глутамінова кислота подібним же чином може «заміщати» аргінін. Потреба в метіоніні можна компенсувати гомоцистеїну з додаванням адекватної кількості донорів метильної групи.
Таким чином, для судження про «незамінності» амінокислоти необхідно не просто виходити із зазначених вище критеріїв, але і враховувати інші компоненти пиши. Крім того, потреба в амінокислотах змінюється в залежності від фізіологічного стану людини (наприклад, під час вагітності, лактації або хвороби), від його віку і, можливо, від складу його кишкової флори.