| Головна |
| «« | ЗМІСТ | »» |
|---|
При вивченні біохімічних перетворень в першу чергу необхідно знати, які продукти С, D, ... утворюються з даних реагентів А, В, ..., також повинні бути відомі стехиометричні числа а, в, с, d, ... в хімічному рівнянні реакції аА + ВВ + ... = сС + Сю + ... Але, якщо реакція складна, для передбачення залежності її швидкості від концентрації реагентів знати хімічне рівняння недостатньо. Потрібно знати також кінетичний механізм, т. Е. Елементарні стадії, через які здійснюється досліджуване перетворення.
За кінетичного механізму всі складні хімічні реакції підрозділяють на два великі класи: послідовні реакції і паралельні (конкуруючі) реакції.
Послідовними називаються складні реакції, в яких продукт Х1 першої елементарної стадії вступає в реакцію другій стадії, продукт Х2 другій стадії вступає в третю і т. Д., Поки не утвориться кінцевий продукт Р:
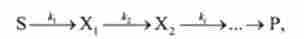
де до, кг, ...- константи швидкості першої, другої і наступних стадій; S - вихідний реагент (субстрат).
Практично всі процеси метаболізму є послідовними реакціями. Прикладом може служити катаболізм глюкози, розглянутий вище (див. Розд. 9.2).
У біохімії реагент S, що вступає в реакцію, називається субстратом. Речовини, що утворюються в проміжних стадіях, називаються проміжними продуктами або интермедиатами. Очевидно, що інтермедіати Х |, Х2,... стадій 1,2, ...- це одночасно субстрати наступних стадій.
Таким чином, при катаболизме глюкози (див. Рис. 9.2) вихідним субстратом є глюкоза, интермедиатами Х |, Х2, Хз, ...- глюкоза-6-фосфат, фруктоза-1,6- дифосфат і т. Д., Кінцевими продуктами Р - діоксид вуглецю С02 і вода Н20.
Найпростішу послідовну реакцію, що складається з двох мономолекуляр- них стадій, записують у вигляді
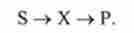
Кінетика цієї реакції описується системою з трьох диференціальних рівнянь, які складаються для швидкості простих реакцій на основі закону діючих мас (10.3):
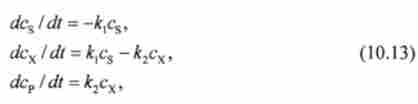
де cs, сх, ср - концентрації речовин S, X, Р.
Інтегрування системи рівнянь (10.13) дає рішення у вигляді залежності концентрацій з $, з, ср від часу. Графіки цих залежностей, т. Е. Кінетичні криві, наведені на рис. 10.4. Вони відображають найбільш характерні особливості послідовних реакцій. Концентрація cs вихідного субстрату монотонно зменшується з часом. Концентрація сх интермедиата спочатку зростає, досягає максимуму, потім падає. Концентрація ср кінцевого продукту монотонно зростає з часом.
Аналіз рішення системи (10.13) показує, що швидкість перетворень складних послідовних реакцій визначається найбільш повільної стадією. Істотно, що рішення системи (10.13) може служити математичною моделлю кінетики найрізноманітніших біологічних перетворень.
У фармакокінетики, наприклад, закономірностями подібного типу описується кінетика проходження лікарської речовини через організм.
Звичайний шлях лікарської речовини в організмі (рис. 10.5) можна розглядати як послідовність двох процесів: всмоктування зі шлунка в кров (характеризується константою всмоктування до,) і виведення (елімінація) з крові в сечу (характеризується константою виведення дое).
Кінетика зміни маси лікарської речовини в шлунку тж. крові тДо і сечі тн описується системою трьох диференціальних рівнянь. Ця система рівнянь аналогічна системі для двох розглянутих вище послідовних реакцій:
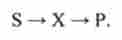
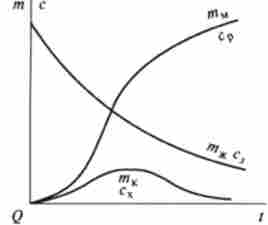
Мал. 10.4. Кінетичні криві субстрату (з $), интермедиата (зх) І продукту (зР) В послідовної реакції S-> X- »Р
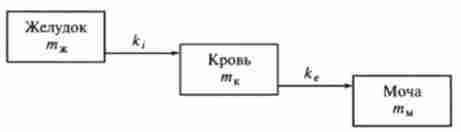
Рис 10.5. Фармакокінетична модель проходження лікарської речовини через організм
Відповідно і рівняння кінетики, і кінетичні криві для цих, по суті, різних процесів будуть якісно подібні.
Так, графіки, наведені на рис. 10.4, відображають кінетику зміни маси лікарської речовини в шлунку, крові і сечі, якщо замість концентрацій Cs,? х з? розглядати маси тж, тдо, тч відповідно, а замість констант до, до2 взяти константи всмоктування і виведення до "доз.
Згідно рис. 10.4 зміст лікарської речовини в крові в залежності від часу описується кривої з максимумом, відповідним максимальному вмісту цієї речовини в крові.
Максимальний вміст лікарської речовини в крові повинно бути більше деякого мінімального (чинного) значення, але не вище деякого максимального (токсичного) значення. Тільки за цієї умови забезпечується лікувальну дію ліки.
На основі графіка залежності змісту лікарської речовини в крові від часу можна прогнозувати вводиться дозу цієї речовини то і час прийому чергової дози.
Наукова дисципліна, що вивчає зміна змісту лікарської речовини в різних частинах організму від часу, називається фармакокинетикой (Від грец. «Farmakon» - ліки). Це одна з наймолодших і швидко розвиваються медичних дисциплін. Вона являє собою вчення про кінетичних закономірностях розподілу сторонніх речовин, зокрема лікарських препаратів, у внутрішньому середовищі організму.
На відміну від біохімії фармакокінетика не займається механізмами перетворення чужорідних речовин. Її головне завдання - кількісне опис за допомогою рівнянь кінетики протікання в часі процесів всмоктування, розподілу, метаболізму та екскреції препаратів. На цій основі встановлюється зв'язок між концентрацією чужорідної речовини в області його дії і величиною ефекту.
Фармакокінетика широко використовує прийоми математичного моделювання, добре відомі з біологічної кібернетики. Найбільш простою моделлю організму з введеної в нього дозою ліки є посудину з розчином цих ліків (рис. 10.6, а). Обсяг судини можна вважати приблизно рівним обсягом рідкої середовища організму, в середньому близько 7,5 л. Одна зі стінок посудини напівпроникна: пропускає назовні лікарська речовина і не пропускає розчинник. Так моделюється система виведення речовини з організму. Передбачається, що швидкість виведення описується законом першого порядку, т. Е. Пропорційнамасі речовини т в організмі в даний момент:

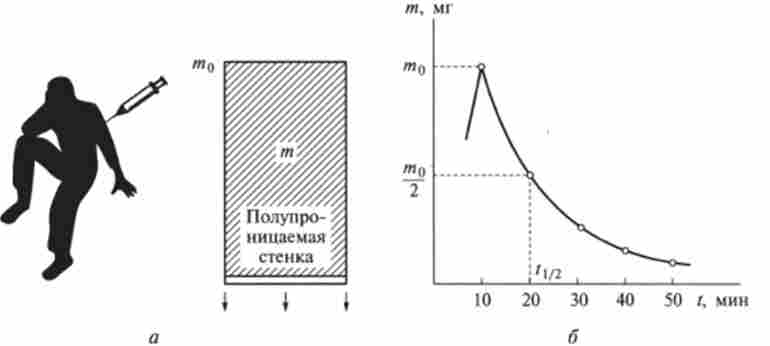
Мал. 10.6. Проста модель фармакокінетики введення і виведення ліків з організму: а - посудину, що моделює рідку середу організму з введенням ліками (лоза / По); б - кінетична крива введення і виведення ліків з організму: / 1 / 2- час полувивеленія (20 хв)
Очевидно, що з математичної точки зору цей вислів зовсім ідентично закону першого порядку (10.4). Різниця полягає в тому. що залежить від часу змінної тут є маса т ліки в організмі, а не концентрація реагенту і замість константи швидкості реакції до використовується константа елімінації (виведення) цих ліків з організму доз. Отже, рівняння кінетики виведення препарату аналогічно рівнянню кінетики реакції першого порядку (10.5):

де то - початкова доза препарату.
Константа елімінації доз є характеристикою препарату і для різних препаратів має різні значення порядку 10 - 10 5 з '.
Час напіввиведення чужорідної речовини з організму розраховують за допомогою формули, аналогічного рівняння (10.11):

Відповідно до зазначених вище значеннями констант елімінації дое розраховані за формулою (10.16) значення часу напіввиведення різних ліків з організму лежать в межах близько 10 "- 104 с. Це означає, що в організмі ліки можуть перебувати протягом проміжку часу від декількох десятків хвилин до десятків годин. Очевидно, наскільки важливо лікаря знати час напіввиведення ліків, оскільки саме ця величина дозволяє визначити дозування і час (частоту) прийому ліків.
Слід зазначити, що тимчасовим залежностям, аналогічним фармакокинетичним, підпорядковується проходження через організм самих різних речовин, у тому числі харчових і отруйних.
Наука, що вивчає зміна змісту токсичної речовини в різних частинах організму від часу його прийому, називається струмі і коки неті кой (від грец. «Toxikon» - отрута).
Наука, що вивчає зміна змісту харчового речовини в різних частинах організму від часу його прийому, називається нутріентокі неті кой (від грец. «Nutrient» - їжа).
Важливим випадком послідовних реакцій є оборотні у напрямку реакції, коли продукт прямої реакції є субстратом зворотного. Це наочно видно, якщо оборотну реакцію
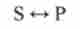
уявити в дві стадії:
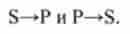
Оборотні у напрямку реакції лежать в основі механізмів регулювання речового складу організму.
Окремим випадком послідовних реакцій є також ланцюгові радикальні реакції, в яких перетворення вихідного субстрату в продукти здійснюється багаторазовим повторенням одних і тих же стадій.
Таким чином розвивається ланцюг реакцій. До ланцюгових реакцій відноситься пе- роксідное окислення ліпідів, що відіграє важливу роль в життєдіяльності організму. Основними стадіями цього процесу є наступні елементарні реакції за участю радикалів:
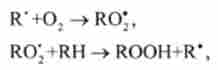
де R * - органічний радикал, утворений в окисно-відновних метаболічнихреакціях липида RH; RO *, - пероксидні радикал; ROOH - органічний пероксид. Радикал R, утворений в другій стадії, знову вступає в першу стадію і т. Д. Ці дві стадії є ланкою ланцюга реакцій.
Багато субстрати і інтермедіати метаболізму беруть участь в конкуруючих реакціях. Конкуруючими називаються складні реакції, в яких один і той же речовина А одночасно взаємодіє з одним або декількома реагентами В |, В2, ... і т. Д., Беручи участь в одночасно протікають реакції:
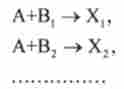
Таким чином, ці реакції «конкурують» один з одним за реагент А.
Використання в залежності від умов різних конкуруючих шляхів метаболізму дозволяє організму здійснювати регулювання процесів життєдіяльності.
Крім двох основних класів - послідовних і конкуруючих реакцій - зустрічаються змішані класи складних реакцій, наприклад послідовно-конкуруючі. До змішаних класах можна віднести пов'язані реакції. Цей клас перетворень широко поширений в процесах метаболізму, що забезпечують життєдіяльність організму.
Одним з основних положень біотермодінамікі є висновок про те, що при постійному тиску в даних умовах мимовільно нездійсненні реакції, що супроводжуються збільшенням енергії Гіббса, т. Е. AG> 0. При зазначених умовах не можна отримати продукт в концентрації, що помітно перевищує рівноважну.
Однак термодинамічно невигідна реакція може здійснитися шляхом сполучення з іншого реакцією, яка характеризується досить великим від'ємним значенням енергії Гіббса, т. Е. AG < 0. Таке поєднання здійснюється через интермедиат X:

Реакція (I) оборотна. Звідси випливає, що, хоча енергія Гіббса AG,0 цієї реакції позитивна, чисельне значення AG, ° невелика. Тому в системі є невелика кількість интермедиата X. Цей интермедиат вступає в термодинамічно вигідну реакцію (II) з AG? <0. Таким чином, за X конкурують зворотна реакція (I) і реакція (II). Оскільки реакція (II) вигідна, може йти ефективну освіту продукту С. який в прямій реакції А + В = С не утворюється внаслідок позитивного значення AG ° цієї реакції.
Оскільки интермедиат X не фігурує в результуючої реакції (III), цю реакцію зручно представити у вигляді суми двох інших реакцій:
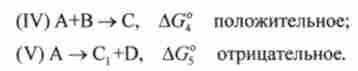
При цьому говорять, що перетворення (IV) пов'язане термодинамічно з перетворенням (V).
Зростання енергії Гіббса в реакції (IV) компенсується відповідним падінням в реакції (V). Таким чином енергія Г Іббсе системи в цілому не змінюється або зменшується відповідно до 2-м початком термодинаміки.
Сполученими називаються такі дві реакції, з яких одна викликає протікання в системі іншої реакції, нездійсненною за відсутності першої.
Слід мати на увазі, що таке уявлення пов'язаних реакцій формально і не відображає кінетичного механізму.
Більшість біохімічних перетворень в організмі здійснюється в результаті сполучення з процесом метаболічного окислення глюкози в циклі Кребса (див. Розд. 9.2). Саме це мають на увазі, коли говорять, що глюкоза є джерелом енергії, що забезпечує життєдіяльність організму.
Один з основних результатів окислення глюкози в організмі - пов'язаний з цим процесом синтез аденозілтріфосфата АТР з аденозілдіфосфата ADP і неорганічного фосфату Р ,:
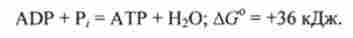
Теоретично при повному окисленні 1 моля глюкози киснем в організмі може утворитися 38 молей АТР. Синтезований АТР потім бере участь в різних пов'язаних реакціях метаболізму, забезпечуючи протікання термодинамічно невигідних процесів.
По механізму, описуваного реакціями (I) і (II), здійснюється ацилирование коферменту-А. Якщо в реакціях (I) і (II) ввести позначення: А - ацетат, А | - АТР, X - Р-ацетат, Di - неорганічний фосфат Р "В - кофермент-А, С - ацілко- фермент-А, С | - ADP, отримують добре відомі реакції (див. Розд. 5.1):
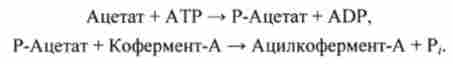
В сумі отримують
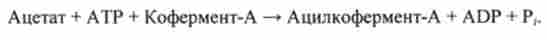
Особливий клас складних реакцій представляють фотохімічні процеси. До цього класу належать реакції, що відбуваються під дією світла. Закономірності та механізми дії світла на біологічні системи вивчає біологія.
Фотохімічні реакції протікають, наприклад, при фотосинтезі, зоровому процесі, освіті засмаги шкіри.
У людини сітківка ока містить два типи світлочутливих клітин - палички і колбочки. Палички містять родопсин - високомолекулярна сполука, що складається з білка опсина і органічної речовини i / wc-ретиналь.
При потраплянні світла на сітківку i / wc-родопсин поглинає квант світла І і переходить в збуджений стан:
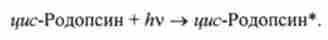
У збудженої молекулі цис-родопсина відбувається цісгрансізомерізація ретінапя і молекула розпадається:
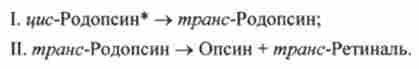
Зміни просторової форми білкової молекули опсина, пов'язані з цістранспревращеніем ретиналю, призводять до зміни величини іонного струму в світлочутливої клітці - паличці. А це, в свою чергу, призводить до виникнення нервового імпульсу, сприйманого мозком як відчуття світла.