| Головна |
| «« | ЗМІСТ | »» |
|---|
Під час обговорення закону діючих мас для швидкості (10.3) спеціально було обумовлено, що константа швидкості є постійна величина, яка не залежить від концентрації реагентів. При цьому передбачалося, що всі хімічні перетворення протікають при постійній температурі.
Разом з тим добре відомо, що швидкість хімічного перетворення може істотно змінюватися при зниженні або підвищенні температури. З точки зору закону діючих мас це зміна швидкості обумовлено температурної залежністю константи швидкості, так як концентрації реагуючих речовин лише незначно змінюються внаслідок теплового розширення або стиснення рідини.
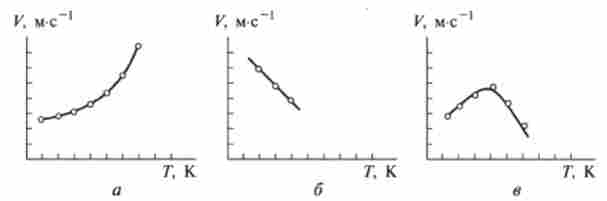
Найбільш добре відомим фактом є зростання швидкості реакцій зі збільшенням температури. Такий тип температурної залежності швидкості називається нормальним (Рис. 10.7, а). Цей тип залежності характерний для всіх простих реакцій. Однак в даний час добре відомі хімічні перетворення, швидкість яких падає зі збільшенням температури. Як приклад можна привести газофазних реакцію оксиду азоту (II) з бромом (рис. 10.7, б). Такий тип температурної залежності швидкості називається аномальним.

Мал. 10.7. Типи температурної залежності швидкості хімічних реакцій: а - нормальна; 6 - аномальна, в - ферментативна
Особливий інтерес для відновлювальної медицини представляє залежність від температури швидкості ферментативних реакцій, т. Е. Реакцій за участю ферментів. Практично всі реакції, що протікають в організмі, відносяться до цього класу.
Наприклад, при розкладанні пероксиду водню в присутності ферменту каталази швидкість розкладання залежить від температури. В інтервалі 273-320 К температурна залежність має нормальний характер. Зі збільшенням температури швидкість зростає, із зменшенням - падає. При підйомі температури вище 320 К спостерігається різке аномальне падіння швидкості розкладання пероксиду. Схожа картина має місце і для інших ферментативних реакцій. Для деяких реакцій цього класу аномалія температурної залежності швидкості виявляється також при Т 273 К в області замерзання водних розчинів (рис. 10.7, в).
Падіння швидкості ферментативних реакцій починаючи з деякої температури обумовлено зниженням активності ферменту в результаті денатурації білка при нагріванні (див. Розд. 8.2). Наприклад, всім відома температурна денатурація яєчного білка.
Нормальне температурна поведінка швидкості різних реакцій визначається наступною залежністю константи швидкості від температури:

де ЕаіА- постійні, нс залежать від температури величини; R - універсальна газова постійна, рівна 8,13 Дж / (моль-К); Т- абсолютна температура.
Вираз (10.17) називається рівнянням Арреніуса для константи швидкості.
величина Е " називається енергією активації реакції. Одиниця її виміру - Дж / моль.
величина А називається предекспонентой. Її розмірність збігається з розмірністю константи швидкості і, отже, залежить від сумарного порядку реакції.
Для реакцій першого порядку одиниця виміру предекспонснти - с, для реакцій другого порядку - л / (моль с).
Як уже зазначалося, для багатьох хімічних реакцій закон діючих мас для швидкості невідомий. Особливо часто це має місце при вивченні біохімічних перетворень. У таких випадках рівняння Арреніуса для опису температурної залежності швидкості перетворення може застосовуватися, але в дещо зміненій формі:

де множник Аз також називається предекспонентой. як і у формулі (10.17). Предекспонента не залежить від температури.
Порівняння закону діючих мас для швидкості (10.3) з рівняннями (10.17) і (10.18) показує, що має місце співвідношення

Звідси випливає, що співвідношення (10.17) можна розглядати як окремий випадок більш загального вигляду рівняння (10.18).
Рівняння (10.17) і (10.18) вказують спосіб обробки експериментальних даних для визначення енергії активації і предекспоненти.
Для ілюстрації можна взяти більш загальний вид рівняння Арреніуса (10.18). Логаріфміруя це рівняння, отримують

Графіки залежності lg v від 1 IT відповідно до рівняння (10.20) виходять у вигляді прямих ліній. Тангенс нахилу прямих дорівнює EJ2.3R, звідки неважко розрахувати значення енергії активації Відрізок, що відсікається на осі ординат, дорівнює предекспоненте Аз.
Для різних реакцій значення енергії активації знаходяться зазвичай в інтервалі приблизно від 10 до 100 кДж / моль.
У практичних цілях для наближеної оцінки величини зміни швидкості реакцій можна використовувати температурний коефіцієнт швидкості Вант Гоффа уд7 - Цей коефіцієнт показує, у скільки разів змінюється швидкість реакції при зміні температури на певну величину, наприклад на Д7 ', рівну 5 або 10 К. З рівняння Аррениуса слід:
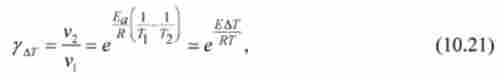
де V |, V2-швидкості досліджуваної реакції при температурах Т і 7V АТ = Т2~ Т - збільшення температури.
З медичної точки зору важливо знати температурний вплив на швидкість біохімічних процесів в області нормальної температури життєдіяльності людського організму Т = 310 К (37 ° С). У діапазоні Т ± АТ = (310 ± 5) К з рівняння отримують

З отриманої формули (10.22) випливає, що коефіцієнт у5 при даній температурі практично лінійно зростає зі зростанням енергії активації Еа. За цією формулою розраховані значення коефіцієнтів Вант-Гоффа і ту для інтервалу енергій активації від 10 до 100 кДж / моль:
|
Еа, кДж / моль |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
У5 |
1,06 |
з |
1,20 |
1,27 |
1,35 |
1,43 |
2,12 |
1,62 |
1,72 |
1,82 |
|
ую |
з |
1,28 |
1,46 |
1,65 |
1,87 |
1,52 |
2,40 |
2,73 |
3,09 |
3,50 |
Очевидно, що в зазначеному інтервалі енергій активації температурний коефіцієнт У5 зростає від 1,06 до 1,82. Це означає, що при енергії активації Еа= 10 000 Дж підвищення температури тіла до 315 К (42 ° С) призводить до збільшення швидкості відповідних біохімічних перетворень всього лише на 6%. Таке незначне зростання швидкості мало позначається на стані систем організму в цілому.
При енергії активації?а= 100 000 Дж те ж саме підвищення температури на 5 ° призводить до збільшення швидкості відповідних цієї енергії реакцій вже на 82%, т. Е. Майже в два рази. Температурне прискорення таких реакцій може істотно впливати на патологічний стан організму в результаті, наприклад, зміни рівня беруть участь в цих реакціях речовин. Цілком можливо, що організм використовує температурний ефект відповідних реакцій з метою регулювання швидкості реакцій для ліквідації патологічних змін свого стану.
У лабораторній практиці реакції можуть проводитися в більш широких температурних інтервалах, ніж це має місце в організмі людини. Тому тут зручніше використовувати температурний коефіцієнт ую, що характеризує зміну швидкості при зміні температури на 10 К. Цей коефіцієнт можна розрахувати також за формулою (10.22), підставляючи в неї значення АТ = 10 К. Коефіцієнт уо істотно перевищує величину у $ і при зміні енергії активації від 10 до 100 кДж зростає від 1,13 до 3,50.